高三化学氮 磷 碳 硅
![]() 双基知识
双基知识
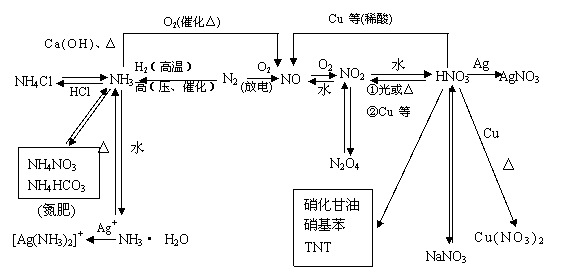
(1)氮及其化合物的知识网络
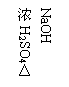
(2)碳及其化合物的知识网络
 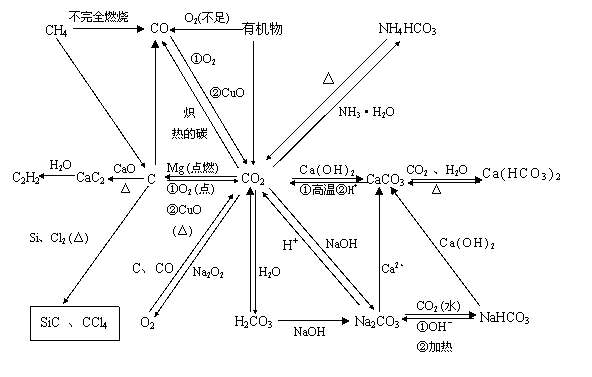 |
(3)硅及其化合物的知识网络
  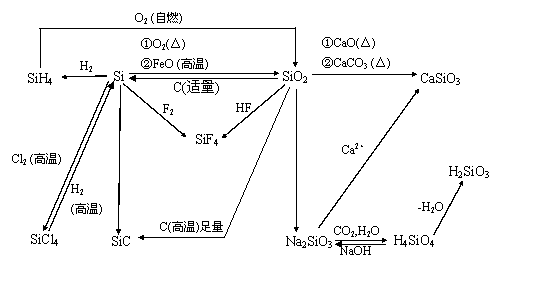 | |||
![]() (2)磷的同分异构体
(2)磷的同分异构体
| 名称 | 白磷 | 红磷 | ||||||
| 分子结构 | 分子式为P4 ,正四面体型, 键角为60°,分子晶体 | 分子晶体,结构复杂 | ||||||
| 颜色状态 | 白色蜡状固体 | 红色粉末状固体 | ||||||
| 溶解性 | 不溶于水,易溶于CS2 | 不溶于水也不溶于CS2 | ||||||
| 毒性 | 剧毒 | 无毒 | ||||||
| 着火点 | 40℃,自燃 | 240℃ | ||||||
| 保存方法 | 保存在水中 | 密封保存 | ||||||
| 用途 | 制磷酸、燃烧弹、烟幕弹 | 制农药、安全火柴等 | ||||||
| 相互转化 |
白磷 红磷 | |||||||
| 主要化性 |
4P + 5O2 2P2O5
2P + 3Cl2 2PCl3(液,形成雾)
2P + 5Cl2 2PCl5(固,形成烟) | |||||||
![]() 巧思巧解
巧思巧解
1。三大强酸的对比
| 硝酸 | 硫酸 | 盐酸 | |
| 重要物理性质 | 纯净硝酸为无色液体,常见浓硝酸因溶有分解产生的NO2 而呈黄色,易挥发。能以任意比与水混溶 | 无色油状液体,难挥发。能以任意比与水混溶 | 纯净盐酸为无色液体,常见盐酸含有工业杂质(Fe3+)而呈黄色 |
| 重要化学性质 | 强酸性;不稳定性,受热见光易分解;浓稀硝酸均有强氧化性 | 强酸性;稀硫酸只表现酸性,浓硫酸既表现酸性又表现吸水性、脱水性、强氧化性 | 强酸性;还原性(浓度越大还原性越强) |
| 实验室制法 | 硝酸钠与浓硫酸微热 | 氯化钠与浓硫酸强热 | |
| 工业制法 | NH3 ~NO~NO2 ~HNO3 注:NO循环氧化吸收 | FeS2~2SO2 ~2SO3 ~2H2SO4 注:SO2 循环氧化吸收 | H2 在Cl2 中燃烧生成的HCl 用水吸收 |
2.关于浓酸变稀的问题
从上表中可看出三大强酸有一个共同的特点——浓度不同时所表现的性质有所不同,记住此点会给我们解题带来重要突破。记住下列反应:
4HNO3(浓) + Cu = Cu(NO3)2 + 2NO2 ↑+ 2H2O
8HNO3(稀) + 3Cu = 3Cu(NO3)2 + 2NO↑+ 4H2O
2H2SO4(浓)+ Zn = ZnSO4 + SO2 ↑+2H2O
![]() H2SO4(稀) + Zn = ZnSO4 + H2 ↑
H2SO4(稀) + Zn = ZnSO4 + H2 ↑
4HCl (浓 + MnO2 MnCl2 +Cl2 ↑+2H2O
3。关于氮的氧化物的计算
在进行氮氧化物计算时,要注意有关循环氧化、由多步反应合并所得总反应的应用。记注下列反应:
4NO2 + O2 + 2H2O = 4HNO3 4NO +3O2 + 2H2O = 4HNO3
![]() NO2 +
NO + 2NaOH = 2NaNO2 + H2O 2NO2
+ 2NaOH = NaNO3 + NaNO2 + H2O
NO2 +
NO + 2NaOH = 2NaNO2 + H2O 2NO2
+ 2NaOH = NaNO3 + NaNO2 + H2O
例题精析
例1,使一定量的Zn 与100 mL 18.5 mol/L浓硫酸充分反应,Zn 完全溶解,同时生成标况下的气体A 33.6 L,将反应后的硫酸稀释至1 L,测得溶液中c (H+ )= 0.1mol/L,求气体A 中各组分的体积比?
例2,将12 mol/L的浓盐酸100 mL与足量的MnO2反应并将产物通入澄清石灰水中,完全反应后生成Ca(ClO)2 的物质的量为 ( )
A,等于0.15 mol B,大于0.15 mol C,小于0.15 mol D,无法确定
例3,为消除NO 、NO2 对大气的污染,常用a mol/L的NaOH 溶液进行吸收(已知反应:①NO2 +NO +2NaOH = 2NaNO2 + H2O ②2NO2 + 2NaOH = NaNO3 +NaNO2 + H2O )。现有m mol NO2 和n mol NO 组成的混合气体,用上述NaOH 溶液吸收至无色气体剩余,则需要上述NaOH 的溶液的体积是 ( )
A,m/a L B,(m+n)/a L C,2(m+n)/a L D,2m/3a L
例4,将38.4 g铜与含2 mol HNO3 的浓硝酸反应至铜完全溶解后,再向深液中加入铜时发现铜不能再溶解,则在铜完全溶解时所放出的气体在标况下的体积约为 ( )
A,17.92 L B, 22.4 L C, 8.96 L D, 11.2 L
参考答案:
例1,1:4;例2,C;例3,B;例4,A;