高三化学第六周周测题
可能用到的相对原子质量:
H:1 C:12 N:14 O:16 Na:23 Fe:56 Ag:108 Cl:35.5 Na:23
一、选择题(本题包括10个小题,每小题4分,共40分。每小题只有一个选项符合题意。)
1.苹果汁是人们喜爱的饮料,由于其中含有亚铁离子,在榨取后不久往往会变为棕黄色,
生产上常在其中加入维生素C以防止其变色,这是利用了维生素C的 ( )
A.氧化性 B.还原性 C.酸性 D.碱性
2.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是 ( )
A.该粒子不显电性 B.该粒子质量数为4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
3.下列各组在溶液中的反应,不管反应物相对量是多少,都只能用同一个离子方程式来表示的是 ( )
A. FeBr2与Cl2 B. Ba(OH)2与H2SO4
C. HCl与Na2CO3 D. Ca(HCO3)2与NaOH
4.一定条件下硝酸铵受热分解的反应式为:NH4NO3→HNO3+N2+H2O 在反应中,被氧化与被还原的氮原子个数之比为 ( )
A.5:3 B.5:4 C.1:1 D.3:5
5.某氯原子的质量是a g ,12C原子的质量是bg ,用NA表示阿伏加德罗常数,下列说法中正确的是。 ( )
A.氯元素的相对原子质量为 12b/a B.m g该氯原子的物质的量一定是m/a NA
C.该氯原子的摩尔质量是aNA D.n g该氯原子所含的电子数为17n/b
6.硝酸铜是制备Cu-Zn-AI系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用
( )
①Cu与稀硝酸反应制取,3Cu+8HN03=3Cu(NO)2+2NO↑+4H20
②Cu与浓硝酸反应制取,Cu+4HN03=Cu(NO3)2+2N02↑+2H20
③通氧气于铜屑与稀硝酸的体系中制取,2Cu+4HN03+02=2Cu(N03)2+2H2O
下列说法不正确的是 ( )
A.制取相同量的硝酸铜需硝酸的量③最少
B.制取相同量的硝酸铜①产生的有毒气体比②少
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
7.维生素E在国外美称之“生命奇迹丸”,是一种脂溶性维生素,对抗衰老等有特殊作用,经研究发现维生素E有α、β、γ、δ四种类型,其结构简式如下:
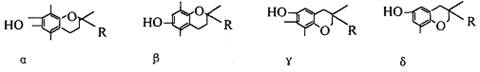
其中R为- CH(CH3)2即:
上述互为同分异构体的是 ( )
A.α β B.β γ C.γδ D.α δ
8.若某池(电解池或原电池)的总反应离子方程式是 :Cu+2H+=== Cu2+ +H2↑,关于此池的有关说法正确的是 ( )
A.该池可能是原电池,也可能是电解池
B.该池只能是原电池,且电解质溶液为硝酸
C.该池只能是电解池,且金属铜为该电解池的阳极
D.该池只能是电解池,电解质溶液可以是硝酸
9.已知物质的量浓度为10.84mol/L的氨水的溶质质量分数为20.00%,则10.00%的氨水的物质的量浓度应为 ( )
A.大于5.42 B.等于5.42 C.小于5.42 D.无法判断
10.用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg [c(H+)/c(OH一)] 。常温下,在AG=10的溶液中能大量共存的离子是: ( )
A.Ca2+、K+、Cl-、SO32- B.NH4+、Fe2+、 I一、SO42-
C.Na+ 、K+、ClO-、S2- D.Na+、S2O32-、AlO2—、K+
二、选择题(本题有8个小题,每小题4分,共32分;每小题有一个或二个选项符合题意。)
11.下列离子方程式正确的是 ( )
A.氢氟酸与氢氧化钾溶液反应: H++OH-=H2 O
B.硫化钠溶于水显碱性: S2-+ 2H2O=H2S↑+ 2OH--
C. 硝酸铁溶液中加过量氨水: Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+
D. 硫酸铜溶液中加入氢氧化钡溶液:Ba2++ SO42-=BaSO4 ↓
12.被誉为“太空金属”的钛,在室温下,不与水、稀硫酸、稀盐酸和稀硝酸作用,但易溶于氢氟酸,其原因可能是 ( )
A.氢氟酸的酸性比其他酸强
B.氢氟酸的氧化性比其他酸强
C.氢氟酸的还原性比其他酸强
D.钛离子易与氟离子形成可溶性难电离物质
13.A、B、C、D、E是原子序数依次增大的五种短周期元素,其原子半径按D、E、B、C、A的顺序依次减小,且B和E同主族,下列推断不正确的是 ( )
A.A、B、D、一定在不同周期
B.A、D不可能在同一主族
C.C和D的单质可能形成离子化合物
D.D 、B、 C、原子的最外层电子数依次减小
14.将标准状况下的a升氯化氢气体溶于1000克水中,得到的盐酸的密度为b克/毫升,则该盐酸的物质的量的浓度是 ( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
15.运用元素周期律分析下面的推断,其中错误的是 ( )
A.铍单质可以和冷水反应并放出氢气。
B.At为有色固体,HAt不稳定,AgAt感光性很强,但不溶于水,也不溶于稀酸
C.磷化氢(PH3)分子中含有未成键的电子对。
D.硒化氢是无色、有毒、比H2S稳定的气体。
16.在水中加入等物质的量的Ag+、Cl-、SO42-、Ba2+、、 Na+、 NO3-、,用惰性电极电解此溶液,通电片刻,则氧化产物与还原产物的质量比为 ( )
A.35.5:10.8 B.16:207 C.8:1 D.108:35.
![]()
![]() 17.恒温恒压下,在容积可变的容器中,反应2NO2(g)
N2O4 (g)达到平衡后,再
17.恒温恒压下,在容积可变的容器中,反应2NO2(g)
N2O4 (g)达到平衡后,再
向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数 ( )
A.不变 B.增大 C.减小 D.无法判断
18. 2001报道硼和镁形成的化合物刷新了金属化合物最高温度的记录。右图示意的是∶该化合物的晶体结构单元;镁原子间形成正六棱柱,且棱柱的上下底面还各有1个镁原子;6个硼原子位于棱柱内。则该化合物的化学式可表示为
 (
)
(
)
A.MgB
B.MgB2
C.Mg2B
D.Mg3B2
19.(7分)在0.5mol·L-1纯碱溶液中滴入酚酞试液变红,若在该溶液中再逐滴滴入过量BaCl2溶液,所观察到的现象是 ;其原因是(用离子反应方程式和简要文字说明):__________________ ________________________________ ________________ ___________________________
三、(本题包括3小题,共28分)
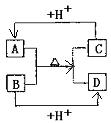 21.(本小题共10分) A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素。其中A中含有5个原子核,它们之间有如下的反应关系:
21.(本小题共10分) A、B、C、D分别是由两种短周期元素组成的常见微粒(或粒子),这四种微粒中均含有相同数目的电子,且共含有三种元素。其中A中含有5个原子核,它们之间有如下的反应关系:
(1)A、D的电子式分别为:A____________,D_______________。
(2)B、C、D三种微粒结合质子能力x>y>z,(x、y、z分别代表B、C、D中的某一种微粒),则x、y、z分别代表的微粒符号为x________,y__________,z________
22.(本小题共8分)
(1)已知氢氧化铁可以被次氯酸钠氧化成FeO4n-,当3.21gFe(OH)3参加反应时,反应中共转移了5.418×1022个电子,则n= ,FeO4n-中铁的化合价为 。
(2)根据上题推断结果,配平下列离子方程式:
[ ]Fe(OH)3+ [ ]ClO- + [ ]OH-—— [ ]FeO4n-+[ ]Cl-+[ ]H2O
(3)结合以上反应,推测FeO4n-能与下列哪些物质反应(填序号) 。
A.Cl2 B.SO2 C.H2S D.O2
23.(10分)某无色溶液可能是由Na2CO3、NaOH、MgCl2、AlCl3、BaCl2、Fe2(SO4)3、(NH4)2SO4溶液中的两种或两种以上混合而成。取该溶液,向其中加入稀硫酸,有白色沉淀生成;继续加入稀硫酸,沉淀又完全消失,整个实验过程中无气体产生。
(1)原溶液是由 和 溶液混合而成的。
(2)整个过程中,有关反应的离子方程式是 、
、 。
班别_____________姓名 __________座号____________ 分数_______________
一、二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
本次周测选择题失分较多的有:5、8、9、12、13、15、16、17、18和21
参考答案
一、二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | C | B | A | B | D | B | C | A | B | C | D | BD | D | AD | C | A | B |
填空题:
19 . (1)生成白色沉淀,红色消失(3分) (2)Ba2+ +CO32-=BaCO3↓,CO32-浓度减少,使平衡CO32-+H2O== HCO3-+OH-向逆反应方向移动,C(CO32-)减少,C(H+) 趋近于10-7mol·L-1 (4分)
21. 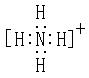
![]() OH- NH3 H2O
OH- NH3 H2O
22. (1)2 +6 (3)B C (2)2, 3 ,4, 2, 3, 5,
23 (1) NaOH AlCl3 (2)Al3+ +4OH- = AlO-2 + 2H2O ;AlO2- +H+ + H2O = Al(OH)3↓
Al(OH)3 + H+ = Al3+ + 2 H2O
一、二、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | B | C | B | A | B | D | B | C | A | B | C | D | BD | D | AD | C | A | B |
填空题:
19 . (1)生成白色沉淀,红色消失(3分) (2)Ba2+ +CO32-=BaCO3↓,CO32-浓度减少,使平衡CO32-+H2O== HCO3-+OH-向逆反应方向移动,C(CO32-)减少,C(H+) 趋近于10-7mol·L-1 (4分)
21. 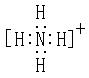
![]() OH- NH3 H2O
OH- NH3 H2O
22. (1)2 +6 (3)B C (2)2, 3 ,4, 2, 3, 5,
23 (1) NaOH AlCl3 (2)Al3+ +4OH- = AlO-2 + 2H2O ;AlO2- +H+ + H2O = Al(OH)3↓
Al(OH)3 + H+ = Al3+ + 2 H2O