高三年级第二次考试化学试卷
相对原子质量:H—1 C—12 N—14 O—16 Na—23 A1—27 Mg—24 P—31 C1—35.5 Fe—56 K—39 Mn—55 Cu-64
一.选择题(48分,每小题只有一个正确选项)
1、下列说法不科学的是 ( )
A.“水滴石穿”主要是溶解了CO2的雨水与CaCO3长期作用生成可溶性的Ca(HCO3)2的缘故
B.变质的油脂有难闻的特殊气味,是由于油脂与水发生了水解反应
C.农业上常用福尔马林溶液来浸种,原因是福尔马林具有杀菌和防腐作用
D.臭氧是饮水的理想消毒剂之一,因为它杀菌能力强且又不影响水质
2. 已知反应2X—+Z2=2Z—+X2、2W—+X2=2X—+W2能从左向右进行,则反应:W2+2Z—=Z2+2W—进行的方向是
A.从左向右 B.从右向左 C.不能进行 D.无法判断
3. 在一种酸性溶液中可能存在Fe3+、NO3-、Cl-、I-中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中:
A. 一定有I-、Cl- B. 可能含有NO3-、Cl-、I-
C. 不含Fe3+ D. 可能含有NO3-
4.设NA为阿佛加德罗常数,下列叙述中正确的是 ( )
A.46 g NO2 和 N2O4混合气体中含有原子数为3NA
B.标准状况下22.4 L H2 中含中子数为2NA
C.1L 1mol/L醋酸溶液中离子总数为2NA
D.2.24升甲烷和氨气的混合气中所含的电子数为NA
5.已知:Na2S2O3的学名叫硫代硫酸钠;C2H5SH的名称叫乙硫醇;Ba2O2叫过氧化钡。试综合上述命名规律,分析下列物质的化学式与名称不相对应的是
(A)K2CS3:三硫代碳酸钾 (B)Na2S2:过硫化钠
![]()
![]() (C)CH3C-OH:乙硫酸
(D)CH3CH2CH:丙硫醛
(C)CH3C-OH:乙硫酸
(D)CH3CH2CH:丙硫醛
S S
6.![]() 能被高锰酸钾氧化生成二氧化碳.实验测知每生成1120 mL(标准状况)二氧化碳需消耗100
mL 0.1 mol/L的高锰酸钾溶液,则反应后锰元素的化合价为( ).
能被高锰酸钾氧化生成二氧化碳.实验测知每生成1120 mL(标准状况)二氧化碳需消耗100
mL 0.1 mol/L的高锰酸钾溶液,则反应后锰元素的化合价为( ).
A.+6 B.+4 C.+2 D.无法确定
7、表示下列变化的化学用语正确的是 ( )
![]()
|
B.用石墨电极电解硫酸铜溶液:2Cu2++2H2O O2↑+2Cu+4H+
C.AlCl3溶液中加入过量氨水:Al3++4NH3·H2O AlO2-+4NH4++2H2O
D.H2的燃烧热为285.8kJ/mol:2H2(g)+O2(g) 2H2O(1);△H=-285.8kJ/mol
8.某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复原来的温度.下列叙述正确的是( )
A.沉淀物的质量为5.6g
B.沉淀物的质量为7.4g
C.饱和石灰水的质量大于98.2g
D.饱和石灰水的质量小于98.2g
9.2005年3月29日晚6时50分,京沪高速公路淮安段上行线103K+300M处,一辆载有约35吨液氯的山东槽罐车与一辆山东货车相撞,导致槽罐车液氯大面积泄漏,造成28人死亡,中毒入院人数为350名。作为救援消防干警在现场的下列处理方法和过程较合理的是
①及时转移疏散人群,同时向有关部门如实报告事故有关情况;
②被转移人群应戴上用浓NaOH处理过的口罩;
③用高压水枪向空另喷洒含碱性物质的水溶液;
④被转移人群可戴上用Na2CO3处理过的口罩(湿润);
⑤将人群转移到地势较低的地方即可,不必走太远;
⑥及时清理现场,检查水源和食物等是否被污染;
⑦常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。
A.②③④⑤ B.①③⑤⑦ C.①②⑤⑥ D. ①③④⑥
10.现有两种不含结晶水的盐,它们在不同温度下的溶解度分别是:
20℃ 50℃
A的溶解度 35.7g 46.4g
B的溶解度 31.6g 108g
下列说法中,正确的是
A.不可采用重结晶法使A、B混合物分离
B.若把108gB的饱和溶液从50℃降到20℃,析出的B是76.4g
C.在20℃时,A、B都可以配成溶质质量分数为25%的不饱和溶液
D.在某一温度下,两种盐的饱和溶液的浓度相同
11.下列各项中化学用语表达正确的是
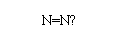 A、N2的结构式:
B、热化学方程式:H++OH-=H2O;△H=-57.3kJ/mol
A、N2的结构式:
B、热化学方程式:H++OH-=H2O;△H=-57.3kJ/mol
![]()
![]()
12.下列有关物质分类或归类正确的是
①混合物:石炭酸、福尔马林、水玻璃、水银; ②化合物:CaCl2,烧碱、聚苯乙烯、HD
③电解质:明矾、胆矾、冰醋酸、硫酸钡 ④同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2;
⑤同素异形体:C60,C70,金刚石、石墨
A.①③④ B.③⑤ C.②③④ D.②④
13.在给定的四种溶液中,各离子能大量共存的是
A.滴加石蕊试液显红色的溶液:Fe3+、NH4+、Cl-.I—
B.能使pH试纸变为蓝色的溶液:Na+、C1-、S2-、SO32-
C.含有大量H+的无色溶液:Na+、Fe3+、NO3-、MnO4-
D.所含溶质为NaNO3的溶液:K+、HSO4-、C1-、S2O32
14.类推的思维方法在化学学习与研究中常会产生错误的结论。因此类推出的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中正确的是
A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
![]()
C.钠与水反应生成NaOH和H2;所有较活泼金属与水反应都生成碱和H2
D.CO2通人Ca(ClO)2溶液生成CaCO3和HClO,SO2通人Ca(ClO)2溶液也生成CaSO3和HClO
15.下列关于氧化物的叙述中正确的是
①碱都有对应的碱性氧化物 ②不能与酸反应的氧化物一定能跟碱反应 ③酸性氧 化物均可与强碱反应 ④既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物为两性氧化物 ⑤酸酐都是酸性氧化物 ⑥氧化物与水的反应都是化合反应 ⑦能与酸反应的氧化物一定是碱性氧化物
(A)①③④⑤ (B)①④⑥⑦ (C)③④ (D)③④⑤⑦
16.已知2H2S+SO2=3S↓+2H2O。向一定量的Na2S与Na2S2O3固体混合物中加入适量的稀H2SO4,恰好完全反应,得到amol的沉淀和bmol的气体,下列有关物质的量的分析中错误的是
(A)还原剂的物质的量可能为a/2mol,氧化剂的物质的量可能为(b+a/4)mol
(B)硫化钠的物质的量可能为(b+a/2)mol
(C)硫代硫酸钠的物质的量可能为(a/4+3b/4)mol
(D)消耗的硫酸的物质的量可能为(b+3a/4)mol
二.填空题(46分)
17.(8分)NaBH4作为还原剂,在有机化学中有极为广泛的用途:
(1)NaBH4极易溶于水并与水反应产生H2,反应后B元素以BO2-的形式存在于溶液中,
此反应的离子方程式为 ;
(2)该反应与溶液酸碱度有关。PH越小,反应速率越 ,理由是
;
(3)NaBH4可使许多金属离子还原为金属单质。例如它可以使含有金离子(Au3+)
的废液中Au3+还原为Au单质(碱性环境,反应后B仍以BO2-存于溶液中)。此反应的离子方程式为
18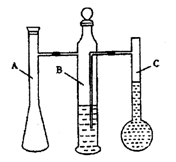 (12分)学生甲利用下图所示实验装置来测定镁元素的相对原子质量
(12分)学生甲利用下图所示实验装置来测定镁元素的相对原子质量
(1)甲图中,A作为 ,C作为 A中发生反应的离子方程式为_____________________ ___________ ________。
(2)学生甲的实验数据如下:消耗镁带的质量为0.112g,产生H2的体积(已折合成标准状况)为104mL,由此计算得出镁元素的相对原子质量为__________(保留1位小数)。目前国际公认的镁元素的相对原子质量为24.3,则学生甲在实验中可能引起误差的原因是_________(填编号,多选扣分)
A.镁带中含有跟硫酸不反应的杂质 B.没有除去镁带表面的氧化镁
C.镁带中含有杂质铝 D.所用稀硫酸不足量
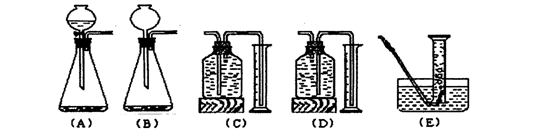 (3)学生乙利用实验室常用的仪器,也组装了一套与学生甲具有相同原理的实验装置。你认为学生乙应选用下列仪器中的________(填编号,多选扣分)
(3)学生乙利用实验室常用的仪器,也组装了一套与学生甲具有相同原理的实验装置。你认为学生乙应选用下列仪器中的________(填编号,多选扣分)
19(8分).已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA,+3价较稳定,NaBiO3溶液为无色。取一定量的Mn(NO3)2溶液依次进行下列实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
 ④最后通入足量的SO2气体,请回答下列问题:
④最后通入足量的SO2气体,请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________________
(2)实验④中的现象为:_______________
(3)实验②③反应的离子方程式分别是:②_______________________、③_____________________
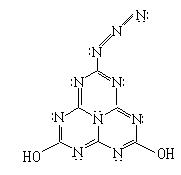
20.(8分)2001年是20世纪伟大的化学家鲍林(Linus Pauling 1901~1994)诞辰100周年纪念。他是一位化学结构大师,因对化学键的本性及其对复杂物质结构的解释而获得1954年度的诺贝尔化学奖。1994年这位世纪老人谢世,人们打开他的办公室,发现里面有一块黑板,画得满满的,其中有一结构式如图所示。老人为什么画这个结构式?它在自然界存在吗?它是炸药吗?它能合成吗?它有什么性质?……不得而知。这是鲍林留给世人的一个谜。也许有朝一日能解开它。
请你对这个结构作一番分析后,回答下列问题。
⑴它的分子式是 。
⑵如果该分子中的氮原子都在一个平面上,那么该分子中的所有原子是否可能处于同一平面内 (填“可能”或“不可能”)。
⑶该分子的侧链相当于叠氮酸根,它类似于一种叫叠氮酸铅的雷管起爆剂,因此有人预测它是炸药,如果它在没有氧气参与的情况下爆炸,反应的化学方程式(发生分解反应,生成两种单质和两种化合物)是
;如果有足量氧气参与的条件下发生爆炸,那么,1mol该化合物爆炸时需消耗 mol氧气。
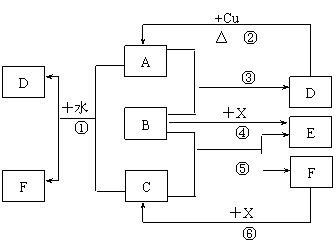 |
21.(10分)已知A~F是中学化学中常见物质,其中A、C、E、F为气体,B、D为液体,D的消费量常作为一个国家工业发达水平的一种标志,F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末,B分子中有18个电子。反应中部分生成物已略去。
试回答下列问题:
⑴根据图中信息,B、C、D、X氧化性从强到弱的顺序是____________________。
⑵B的电子式为_________________。
⑶写出反应②的化学方程式:__________________________________________。
⑷写出反应①、⑥的离子方程式:
①_________________________________________________________________。
⑥_________________________________________________________________。
三.计算题
22(6分)20℃时,氯化钠的溶解度是36克,在该温度下取一定量的饱和食盐水用惰性电极进行电解,当阳极析出气体11·2升(标准状况下)时,食盐溶液被完全电解,所得溶液的密度为1.2g·cm-3。试计算:
(1) 电解前饱和食盐水的质量分数。
(2) 电解完全后所得溶液的物质的量浓度。
参考答案
1B2B 3C 4A 5C 6C 7B 8D 9D 10.D11D 12B 13B 14A 15C 16A
17(8分).(1)BH4-+2H2O=BO2-+4H2↑;
(2)快 反应的实质是H+与BH4-反应,pH越小,H+浓度越大,反应越快;
(3)3BH4-+8Au3++24OH-=8Au+3BO2-+18H2O
18、(12分)(1)气体发生器 储液瓶
Mg+2H+→Mg2++H2↑ (2)24.1 C (3)AD
19⑴PbO2>KMnO4>H2O2 (2分) ⑵紫红色褪去,生成白色沉淀(2分)
⑶②2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H (2分)
③5PbO2+2Mn2++4H+=5Pb2++2MnO4-+2H2O(2分)
20.(8分)(1)C6H2N10O2 (1分) (2)可能 (1分)
(3)C6H2N10O2=H2O↑+CO↑+5N2↑+5C 5.5mol (各2分)
21.(10分)
(1)X>C>B>D(或写作MnO2>Cl2>H2O2>H2SO4)(2分)
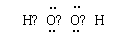 (2)(2分)
(2)(2分)
(3)Cu
+2H2SO4(浓)![]() CuSO4 +SO2 ↑+2H2O (2分)
CuSO4 +SO2 ↑+2H2O (2分)
(4)Cl2 +SO2 +2H2O = 4H+ +SO42-+2Cl- (2分)
MnO2 +4H+
+ 2Cl-![]() Mn2+ +Cl2 ↑+2H2O (2分)
Mn2+ +Cl2 ↑+2H2O (2分)
22.(1)26.5%
(2)6.5mol·L-1