高三年级第三次月考化学试卷
相对原子质量:H 1;C 12;N:14;O 16;Na:23;Al:27;P:31;Cl:35.5;Fe 56;Cu 64;
Zn 65;Ba 137
一.选择题:(请将正确答案填涂在机读卡上)
1.下列变化属于物理变化的是
A.O2在放电条件下变成O3 B.加热胆矾成无水硫酸铜
C.漂白的草帽久置于空气中变黄 D.氢氧化铁胶体加入MgSO4溶液产生沉淀
2.在一定的条件下,当64 g SO2气体被氧化成SO3气体时,共放出热量98.3 kJ。已知SO2在此条件下转化率为80%,据此,下列热化学方程式正确的是
 A.SO2(g)+
A.SO2(g)+
![]() O2(g) SO3(g)
O2(g) SO3(g) ![]()
B.2SO2(g)+O2(g) 2SO3(l) ![]()
C.SO2(g)+![]() O2(g) SO3(g)
O2(g) SO3(g) ![]()
D.2SO2(g)+O2(g) 2SO3(g) ![]()
3.以NA表示阿佛加德罗常数的值,下列说法中正确的是
A.在31g白磷中含有NA个P—P键
B.0.1 mol Na与O2在一定条件下反应生成Na2O和Na2O2混合物时,失去的电子数为0.1NA
C.1.8g重水(D2O)中含NA个中子
D.标准状况下11.2L臭氧中含NA个氧原子
4.酸根离子RO![]() 所含电子数比NO
所含电子数比NO![]() 的电子数多10,则下列说法中正确的是
的电子数多10,则下列说法中正确的是
A.R原子的电子层数与N原子电子层数相同
B.RO![]() 中R的化合价与NO
中R的化合价与NO![]() 中的N的化合价相同
中的N的化合价相同
C.RO![]() 与NO
与NO![]() 只能被还原,不能被氧化
只能被还原,不能被氧化
D.R与N为同族元素
5.元素X和Y在元素周期素中处于相邻周期,两种元素原子的质子数之和为21,Y元素原子的核外电子数比X元素原子的核外电子数多5。则下列叙述不正确的是
A.X和Y两元素形成的化合物在熔融状态下电解可以得到两元素的单质
B.Y元素的单质不能和金属氧化物反应
C.X和Y能构成一种阴离子,这种阴离子与过量H+反应可以转变为Y元素的阳离子
D.X元素的一种单质能有效地吸收太阳光线中的紫外线
6.短周期的三种元素分别为X、Y和Z,已知X元素的原子最外层只有一个电子,Y元素原子的M电子层上的电子数是它的K层和L层电子总数的一半,Z元素原子的L电子层上的电子数比Y元素原子的L层上的电子数少2个。则这三种元素所组成的化合物的分子式不可能是
A.X2YZ4 B.XYZ3 C.X3YZ3 D.X3YZ4
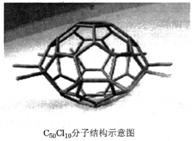 7.厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子如下图,50个碳原子组成若干个正六边形和正五边形,碳均为四价。有关C50Cl10的说法不正确的
7.厦门大学郑兰荪院士合成了C50Cl10富勒烯足球状分子如下图,50个碳原子组成若干个正六边形和正五边形,碳均为四价。有关C50Cl10的说法不正确的
是
A.C50Cl10与C60互为同素异形体
B.C50Cl10分子中共用电子对数目为105个
C.C50Cl10相对分子质量为955
D.C50Cl10分子中含有55个碳碳单键
8.某无色透明的溶液中,放入铝片,立即有大量H2放出,则下列离子在溶液中可以大量存在的是
A.Ca2+、H2PO4-、Cl-、Na+ B.H+、Mg2+、![]() 、Ba2+
、Ba2+
C.S2-、SO32-、K+、SO42- D.Na+、K+、ClO-、SO32-
9.下列离子方程式中正确的是
A.NH4HSO4溶液中加入少量NaOH:NH4++OH-=NH3·H2O
B.饱和石灰水与醋酸溶液混合:Ca(OH)2+2CH3COOH=Ca2++2CH3COO-+2H2O
C.氢氧化镁溶于稀硫酸:Mg(OH)2+2H+=Mg2++2H2O
D.氯气通入Na2SO3溶液中:Cl2+SO32-+H2O=SO42-+2HCl
10.30℃时,在0.1mol/L的Na2S、NaHS两溶液中均存在的关系是
A.c(H+)·c(OH-)>1×10-14 B.c(Na+)=c(S2-)+c(HS-)+c(H2S)
C.c(OH-)=c(H+)+c(HS-)+2c(H2S) D.c(Na+)+c(H+)=c(OH-)+c(HS-)+c(S2-)
11.今有甲、乙、丙三瓶等体积等浓度的新制氯水,浓度均为0.1mol·l-1。如果甲瓶中加入少量的NaHCO3晶体m mol,在乙瓶中加入少量的NaHSO3晶体m mol,丙瓶不变,片刻后,甲、乙、丙三瓶中HClO的物质的量浓度大小关系是(溶液体积变化忽略不计)
A.甲=乙>丙 B.甲>丙>乙 C.丙>甲=乙 D.乙>甲>丙
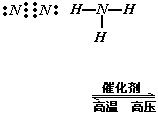
12.某炼金厂的废水因连降暴雨而溢出,导致河水严重污染。炼金废水中所含CN-有剧毒,其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸。下列说法不正确的是
A.CN-可以和稀硫酸反应生成HCN B.CN-可被Cl2氧化成(CN)2
C.在水溶液中(CN)2可被Br-还原 D.HCN的电子式为 ![]()
13.下列物质的溶液吸收SO2后,既无沉淀也无气体产生的是
①BaCl2 ②NaHCO3 ③Na2SO3 ④Na2SiO3 ⑤溴水
A.①②③ B.②③⑤ C.①③⑤ D.④⑤
14.已知反应:![]() ,下列说法正确的
,下列说法正确的
A.该反应不属于氧化还原反应 B.XeF4既是氧化剂,又是还原剂
C.反应中电子由Xe转移到C D.氧化剂与还原剂的物质的量之比为1:2
15.在一定条件下,硫酸铵的分解反应为:4(NH4)2SO4=N2↑+6NH3↑+3SO2↑+SO3↑+7H2O,当有nmol电子转移时,下列说法不正确的是
A.有2/3nmol(NH4)2SO4分解 B.有![]() 原子被还原
原子被还原
C.生成![]() 氧化产物 D.生成7nmolH2O
氧化产物 D.生成7nmolH2O
![]() 16.在恒温恒容的容器中进行反应N2O4(g) 2NO2(g);△H>0,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么,反应物浓度由0.06mol/L降到0.024mol/L,需反应的时间为
16.在恒温恒容的容器中进行反应N2O4(g) 2NO2(g);△H>0,若反应物浓度由0.1mol/L降到0.06mol/L需20s,那么,反应物浓度由0.06mol/L降到0.024mol/L,需反应的时间为
A.等于18s B.等于12s C.大于18s D.小于18s
17.在一定体积和一定条件下有反应N2(g)+3H2(g)![]() 2NH3(g),现分别从两条途径建立平衡:
2NH3(g),现分别从两条途径建立平衡:
I.起始浓度 N2 l mol·L-1,H2 3 mol·L-1
II.起始浓度 N2 2 mol·L-1,H2 6 mol·L-1
下列叙述正确的是
A. I和II两途径达到平衡时,体系内各成分的体积分数相同
B.达到平衡时,途径I的反应速率v(H2)等于途径II的反应速率v(H2)
C.达到平衡时,途径I体系内混合气体的密度为途径II体系内混合气体的密度的![]()
 D.达到平衡时,途径II体系内混合气体的压强是途径I内混合气体压强的2倍
D.达到平衡时,途径II体系内混合气体的压强是途径I内混合气体压强的2倍
18.
都属于萘的同系物。萘和萘的同系物分子组成通式是
A.CnH2n-6(n≥11) B.CnH2n-8(n>10) C.CnH2n-10(n≥10) D.CnH2n-12(n≥10)
19.过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,它可由冰醋酸与过氧化氢在一定条件下制得;它可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢,有关过氧乙酸的叙述正确的是
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸可与苯酚混合使用
C.由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应
D.浓过氧乙酸中加入少许紫色石蕊试液,振荡后试液一定呈红色
20.在一定温度下,b g固体A能完全溶解于水形成(a+b)g溶液(固体A不含结晶水,也不与水反应),则该温度下,固体A的溶解度肯定不可能的是
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
21.K35ClO3晶体与H37Cl浓溶液反应,生成氯气、氯化钾和水,此反应生成的这种氯气的摩尔质量为
A.74g·mol-1 B.73.3 g·mol-1 C.72 g·mol-1 D.70.6 g·mol-1
22.恒温、恒压下,在一个容积可变的密闭容器中发生如下反应:
![]() A(g)+B(g) C(g),若开始时通入1molA和1molB,到达平衡后,生成amolC。则下列说法错误的是
A(g)+B(g) C(g),若开始时通入1molA和1molB,到达平衡后,生成amolC。则下列说法错误的是
①若开始时通入3molA和3molB,到达平衡后,生成C的物质的量为3amol
②若开始时通入xmolA、2molB和1molC,到达平衡后,A和C的物质的量分别为ymol和3amol,则x=2,y=1.5
③若开始时通入4molA、4molB和2molC,到达平衡后,B的物质的量一定大于4mol
④若开始时通入2molA、2molB和1molC,到达平衡后,再通入3molC,则再次达平衡后,C的物质的量分数为![]()
A.②④ B.③④ C.③ D.②③
二.填空题:
23.A、B、C、D、E为中学常见的五种物质,均含元素Y,有的还可能含有元素X、Z,元素X、Y、Z的原子序数依次递增。
①元素Y在A、B、C、D、E中所呈现的化合价依次递增,其中只有B为单质;
②常温下将气体D通入水中发生反应,生成C和E;
③工业上以A、空气和水为原料,通过催化氧化法制取E。
请回答以下问题:
(1)B的电子式为___________,A的结构式为____________;
(2)写出②中涉及反应的化学方程式________________;
(3)由B反应生成1 mol A放出的热量为46.2 kJ,写出该反应的热化学方程式,并注明反应条件____________________________________________________;
(4)工业上,若输送Cl2的管道漏气,用A进行检验时可观察到大量白烟,同时有B生成,写出有关反应的化学方程式__________________________。
24.化学工业在江苏国民经济中占有极其重要的地位,我省是国内最早的硫酸生产基地之一。
(1)硫酸生产中,根据化学平衡原理来确定的条件或措施有_______(填序号)
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.接触室中不使用很高的温度
D.净化后炉气中要有过量的空气
E.接触氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(2)若实验室外在537oC、1.01×105Pa和催化剂存在条件下,向某密闭容器中充入1 mol SO2和0.5 mol O2,此时体积为100L,在温度和压强不变条件下反应达到平衡,SO3体积分数为0.91。若保持温度和压强不变,充入1 mol SO3,则平衡时SO2体积分数为____________;若保持温度和体积不变,充入a mol SO2和b mol O2,且a:b=2:1,反应达平衡时SO3体积分数仍为0.91,则a=__________。
(3)硫酸工业的尾气中含有少量的SO2,常用氨水吸收后再加硫酸,回收SO2同时得到化肥硫酸铵,硫酸铵溶液中各离子物质的量浓度由大到小的顺序为_______。
25.燃料电池是使气体燃料氧化直接产生电流的装置,这是本世纪最具挑战性的课题之一。最近有人制造了一种燃料电池,一个电极通入空气,另一电极通入丁烷,电池的电解质是掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。试回答下列问题:
(1)该电池放电时的化学反应方程式为 。
(2)该燃料电池的电极反应式为:
电池正极 13O2+52e- 26O2-
电池负极 2C4H10+26O2--52e- 8CO2+10H2O
则固体电解质中的O2-向 极移动(填“正”或“负”)
(3)某金属的相对原子质量为52.00,用上述电池电解该金属的一种含氧酸盐的酸性水溶液时,阳极每放出3360mL(标准状况)氧气,阴极析出金属10.4g,在该含氧酸盐中金属的化合价为 ,在该实验中,若不考虑能量的损失,电池中消耗丁烷的质量最少是 g(结果精确至0.01g)
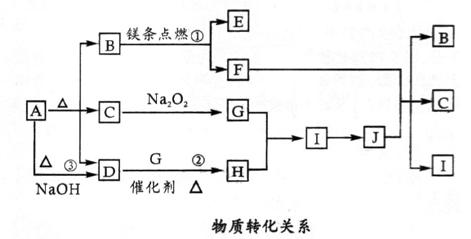 26.图中A—J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
26.图中A—J分别代表相关反应中的一种物质,已知A分解得到等物质的量的B、C、D,图中有部分生成物未标出。
请填写以下空白:
(1)B的电子式__________,D分子的空间构型__________。
(2)写出反应①②的化学方程式:①__________;②____________。
(3)写出反应③的离子方程式:_______________________________。
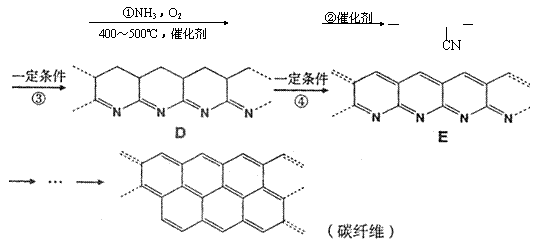 27.碳纤维质轻、耐高温、有很高的抗拉强度与弹性,它与树脂、金属或陶瓷基体形成的复合材料广泛运用于航天飞机、火箭、导弹的外壳以及体育器具等。碳纤维的合成方法一般经历以下过程:
27.碳纤维质轻、耐高温、有很高的抗拉强度与弹性,它与树脂、金属或陶瓷基体形成的复合材料广泛运用于航天飞机、火箭、导弹的外壳以及体育器具等。碳纤维的合成方法一般经历以下过程:
CH2=CH—CH3 CH2=CH—CN [ CH2—CH ]n
A B C
请回答下列问题:
(1)反应①的化学方程式: 。
(2)反应②属于 ;反应④属于 。(请选a、b、c、d填空)
a.加聚反应 b.缩聚反应 c.氧化反应 d.还原反应
(3)在化合物A、B、C、D、E中,所有原子可能在同一平面上的是 。
(4)化合物E中碳元素的质量分数接近于 %。(保留1位小数)
三、实验题
28.实验室分析白铁(镀锌的铁)样品成分,称取1.00 g样品放在烧杯中。加入过量盐酸,然后用玻璃片盖住烧杯,首先观察到大量气体冒出,后来放出气体速率变慢,最后反应完全。接着在反应后的溶液中加入过量的NaOH溶液,过滤分离出灰绿色沉淀,该沉淀在空气中加热至质量不变,最后得到1.20g红色粉末。(已知氢氧化锌是两性氢氧化物)
(1)在铁上镀锌的目的是 ;白铁的镀层损伤后,在潮湿的空气环境中首先被腐蚀的金属是 。
(2)实验中,过滤用到的主要仪器是 ,放出气体速率由快变慢的原因是 。
(3)为什么要加入过量NaOH溶液 。
(4)锌在样品中的质量分数是 。
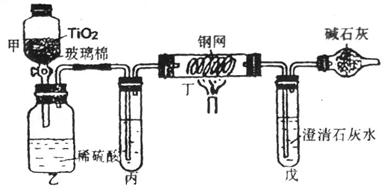 29.含CN-的废水危害很大。处理该废水时,可在催化剂TiO2作用下用NaClO将CN-(C为+2价)氧化成CNO-(C为+4价)。CNO-在酸性条件下继续被NaClO氧化生成N2与CO2。某环保部门用图中装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率。
29.含CN-的废水危害很大。处理该废水时,可在催化剂TiO2作用下用NaClO将CN-(C为+2价)氧化成CNO-(C为+4价)。CNO-在酸性条件下继续被NaClO氧化生成N2与CO2。某环保部门用图中装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率。
将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol·L-1)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞,使溶液全部放入乙中,关闭活塞。
(1)甲中反应的离子方程式为___________________________________________________;乙中反应的离子方程式为____________________________________________。
(2)乙中生成的气体除CO2、N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN-的处理结果。
①丙中加入的除杂试剂是________(填标号)
A.饱和食盐水
B.饱和NaHCO3溶液
C.浓NaOH溶液
D.浓硫酸
②丁在实验中的作用是_________________________________________________。
③戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN-被处理的百分率__________80%(填“>”、“=”、“<”)
四、计算题
30.某温度下,将一定量的密度为1.15g/L的NaCl溶液电解(惰性电极),设NaCl恰好完全电解且无其它反应发生时,得到的溶液中氧元素的质量分数为80%。
求:(1)电解后溶液中溶剂和溶质的物质的量之比。
(2)原溶液的物质的量浓度。
31.某二价金属M的氢氧化物澄清溶液与过量的NaHCO3溶液反应,生成MCO3沉淀,经过滤烘干称重,沉淀的质量为39.4 g,将其与足量盐酸反应,在标准状况下收集到4.48L气体;取滤液的![]() 恰好与70mL盐酸完全反应,在标准状况收集到1.12L气体。
恰好与70mL盐酸完全反应,在标准状况收集到1.12L气体。
(1)写出M的氢氧化物澄清溶液与过量的NaHCO3溶液反应的化学方程式:
_____________________________________________________________。
(2)计算M的相对原子质量和加入的NaHCO3溶液中含NaHCO3的质量。
高三年级第三次月考化学试卷
学号___________班级_________ 姓名__________ 成绩__________
一.选择题:(请将正确答案填涂在机读卡上)
二.填空题:
23.(1)B的电子式____________________;A的结构式_________________________。
(2) ; , 。
(3) 。
(4) 。
24.(1)___________________。
(2)_________________;a=______________________
(3)_________________________________________________
25.(1) 。
(2)
(3) , g。
26.(1)B的电子式_____________________;D的空间构型_______________________。
(2)①______________________________ ② _________________________________
(3)③________________________________________________________
27.(1) 。
(2) ; 。
(3) 。
(4) %
三.实验题:
28.(1) ; 。
(2) ,
。
(3) 。
(4) 。
29.(1)______________________________________________________;
______________________________________________________。
(2)①________
②_________________________________________________。
③__________(填“>”、“=”、“<”)
四.计算题:
30.
31.(1)______________________________________。
(2)
高三年级第三次月考化学试卷答案
一.选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 答案 | D | C | B | B | B | A | A | C | C | A | B |
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 答案 | C | C | D | D | C | C | D | A | C | B | D |
二.填空题:
 23.(1)
(2)3NO2+H2O=2HNO3+NO
23.(1)
(2)3NO2+H2O=2HNO3+NO
(3)N2(g)+3H2(g)
2NH3(g);![]()
(4)8NH3+3Cl2=6NH4Cl+N2
24.(1)CD(2)6%;1.45(3)c(NH4+)>c(SO42-)>c(H+)>c(OH-)
25.(1)2C4H10+13O2=8CO2+10H2O (2)负(3)+3价, 1.34
 26.(1)
三角锥形
26.(1)
三角锥形
(2)①2Mg+CO2 2MgO+C ②4NH3+5O2 4NO+6H2O
(3)NH4++HCO3-+2OH-=NH3↑+CO32-+2H2O
27.(1)2CH2=CH—CH3+2NH3+3O2 2CH2=CH—CN+6H2O
(2)a,c (3)BE
(4)70.6% (70.5%~70.7%均给分)
三、实验题
28.(1)防腐,美观;锌(2)漏斗,烧杯,铁架台,玻璃棒铁圈;反应前期,锌与铁形成原电池反应,且锌较活泼,后期,Fe与酸直接作用,反应慢;
![]() (3)利用Zn(OH)2的两性使Zn存在于溶液中,最后得到纯净的Fe2O3; (4)16%
(3)利用Zn(OH)2的两性使Zn存在于溶液中,最后得到纯净的Fe2O3; (4)16%
29.(1)CN-+ClO- CNO-+Cl-
2CNO-+3ClO-+2H+=N2↑+H2O+3Cl-+2CO2↑
(2)①A ②除去混合气体中的Cl2,防止对CO2测定的影响 ③>
四、计算题(一中)
30.(1)10:1 (2)4.48 mol/L
31.(1)M(OH)2+2NaHCO3=MCO3↓+Na2CO3+H2O
(2)58.8g
四、计算题(益中)
30.(1)M(OH)2+2NaHCO3=MCO3↓+Na2CO3+H2O
(2)58.8g