第二学期
高三年级第五次考试化学试卷
组卷:黄宁生 审核:马明娟 打印:周小中
注意事项:
1、本试卷考试时间为90分钟,满分为150分。
2、将第Ⅰ卷的答案用2B铅笔填涂在答题卡上,将第Ⅱ卷的答案写在答卷纸上。
3、考试结束只交答题卡和答卷纸,试卷请保管好。
4、可能用到的原子量:
H-1 O-16 Na-23 S-32 Fe-56 C-12 N-14 Al-27 K-39 Cl-35.5
第Ⅰ卷(选择题 共74分)
一、选择题:(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1、“纯净水”、“太空水”、“蒸馏水”等作为日常饮用水,因缺少某种成分而不利于儿童的健康发育,你认为制备上述饮用水至少还需要添加的化学物质是
(A)钙、镁的碳酸盐 (B)含碘酸钾的食盐 (C)漂白粉消毒液 (D)小苏打
2、2003年10月15日,我国成功地发射了第一个载人航天飞船----“神舟”五号,从此向全世界宣告我国进入航天大国和航天强国。此次发射用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成氮气和水蒸气。已知:N2(g)+2O2(g)=2NO2(g);△H=+67.7kJ•mol-1,N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534 kJ•mol-1。下列关于肼和二氧化氮反应的热化学方程式中,正确的是
(A)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=-1135.7kJ•mol-1
(B)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(l);△H=+1135.7kJ•mol-1
(C)N2H4(g)+NO2(g)=3/2N2(g)+2H2O(l);△H=-1135.7kJ•mol-1
(D)2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1135.7kJ•mol-1
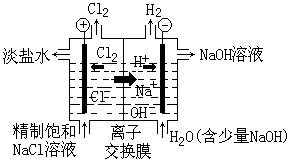 3、2003年诺贝尔化学奖授予美国科学家彼得•阿格雷和罗德里克•麦金农。阿格雷得奖是由于发现了细胞膜水通道,而麦金农的贡献主要是在细胞膜离子通道的结构和机理研究等方面。化学工业中的离子交换膜就是一些具有特定微粒通道的物质:阳离子交换膜只允许阳离子通过,而阻止阴离子和气体通过;阴离子交换膜只允许阴离子通过,而阻止阳离子和气体通过。目前世界上比较先进的电解制碱技术是离子交换膜法。如图是工业上离子交换膜法电解饱和NaCl溶液生产烧碱的原理示意图,其中的离子交换膜是
3、2003年诺贝尔化学奖授予美国科学家彼得•阿格雷和罗德里克•麦金农。阿格雷得奖是由于发现了细胞膜水通道,而麦金农的贡献主要是在细胞膜离子通道的结构和机理研究等方面。化学工业中的离子交换膜就是一些具有特定微粒通道的物质:阳离子交换膜只允许阳离子通过,而阻止阴离子和气体通过;阴离子交换膜只允许阴离子通过,而阻止阳离子和气体通过。目前世界上比较先进的电解制碱技术是离子交换膜法。如图是工业上离子交换膜法电解饱和NaCl溶液生产烧碱的原理示意图,其中的离子交换膜是
(A)石棉隔膜 (B)阳离子交换膜 (C)阴离子交换膜 (D)活性生物细胞膜
4、“家庭水实验”是指利用家庭生活用品进行化学实验,从而对化学进行学习的探讨的活动。下列实验中,不能在家庭中完成的是
(A)CO2气体不能支持蜡烛燃烧 (B)检验自来水中是否含有Cl-
(C)除去热水瓶中的水垢 (D)鉴别羊毛织物和化纤织物
5、浓度不等的两种硫酸溶液等质量混合后,溶液的质量分数为a%,而等体积混合后,溶液的质量分数为b%;浓度不等的两种氨水等质量混合后,其质量分数为a%,而等体积混合后,其质量分数为c%,那么a,b,c数值的关系是
(A)a>b>c (B)b>a>c (C)c>b>a (D)c>a>b
6、已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4溶液与Na2CO3溶液混合
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓
(2)CuSO4溶液与Na2S溶液混合
主要:Cu2++S2-=CuS↓
次要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
则下列物质的溶解度大小的比较中,正确的是
(A)Cu(OH)2>CuCO3>CuS (B)CuS>Cu(OH)2>CuCO3
(C)Cu(OH)2<CuCO3<CuS (D)CuS<Cu(OH)2<CuCO3
7、已知某溶液中c(K+)=c(Cl-)=1/2c(Na+)=c(SO42-),则该溶液中可能含有的溶质是
①KCl和Na2SO4 ②KCl、NaCl和Na2SO4 ③NaCl、Na2SO4和K2SO4 ④KCl、K2SO4和Na2SO4
(A)①② (B)①③ (C)①②③ (D)①④
8、短周期的三种元素分别为X、Y和Z,已知X 元素的原子最外层只有一个电子;Y元素原子的M电子层上的电子数是它K层和L层电子总数的一半;Z元素原子的L电子层上的电子数比Y元素原子的L电子层上电子数少2个。则这三种元素所组成的化合物的化学式不可能是
(A)X2YZ4 (B)XYZ3 (C)X3YZ4 (D)X4Y2Z7
二、选择题:(本题包括10小题,每小题5分,共50分,每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分。)
9、下列实验中,因为缺少必须的步骤造成失败的是①锌与稀硫酸制H2,用排水法(集气瓶装满水)未能收到纯氢气 ②验证RX是碘代烷,把RX与NaOH溶液混合加热后,加入AgNO3溶液产生褐色沉淀 ③将淀粉和少量稀硫酸加热一段时间,加入银氨溶液后,无银镜出现
(A)只有① (B)只有②③ (C)只有③ (D)①②③
10、在一密闭容器中加入A、B、C三种气体。在t1、t2、t3、t4(单位:s)时刻测得各物质的浓度(单位:mol/L)如下:
| 测定时刻/s | t1 | t2 | t3 | t4 |
| A的浓度/mol/L | 6 | 3 | 2 | 2 |
| B的浓度/mol/L | 5 | 3.5 | 3 | 3 |
| C的浓度/mol/L | 1 | 2.5 | 3 | 3 |
据此,下列论述中,正确的是
(A)在容器中发生的反应为:2A+B![]() C
C
(B)在t2~t3时间内A的平均反应速率是1/(t3~t2)mol/L·s
(C)A的转化率比B的转化率低
(D)在t3时刻反应已经停止
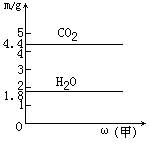 11、将甲与乙混合得到混合物,取一定质量的该混合物进行完全燃烧实验,生成CO2和H2O的质量与甲在混合物中的质量分数关系如下图所示,则甲乙组合正确的是
11、将甲与乙混合得到混合物,取一定质量的该混合物进行完全燃烧实验,生成CO2和H2O的质量与甲在混合物中的质量分数关系如下图所示,则甲乙组合正确的是
| (A) | (B) | (C) | (D) | |
| 甲 | 乙炔 | 甲烷 | 乙烯 | 乙烷 |
| 乙 | 苯 | 丁烯 | 环丙烷 | 乙醇 |
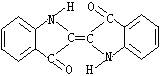 12、历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中,错误的是
12、历史上最早应用的还原性染料是靛蓝,其结构简式如图所示,下列关于靛蓝的叙述中,错误的是
(A)靛蓝由碳、氢、氧、氮四种元素组成
(B)该物质不能使溴的四氯化碳溶液褪色
(C)该物质是高分子化合物
(D)它的分子式是C16H10N2O2
13、锂电池是新一代高能电池,目前已经研究成功多种锂电池。某种锂电池总的反应式为:Li+MnO2=LiMnO2。下列说法中,正确的是
(A)电池放电时,反应混合物由黑色变成紫色 (B)Li是正极,MnO2是负极
(C)放电时负极的反应:Li-e-=Li+ (D)充电时阳极的反应:MnO2-e-=MnO2
14、能正确表示下列化学反应的离子方程式是
(A)用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
(B)金属铝溶于盐酸中:Al+2H+=Al3++H2↑
(C)硫化钠溶于水中:S2-+2H2O=H2S↑+2OH-
(D)碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑
15、设NA表示阿伏加德罗常数,下列叙述中,正确的是
(A)标准状况下,11.2L四氯化碳所含的分子数为0.5NA
(B)1.8g的NH4+中含有的电子数为NA
(C)1mol醋酸分子与NA个醋酸分子的质量相等
(D)2.4g金属镁变为镁离子时失去的电子数为0.1NA
16、Cl2和NO2在室温下可以化合生成一种新的气态化合物C,为了测定C的分子组成,进行了以下实验。取混合气体5L,测定得反应后气体的总体积随Cl2在混合气体中所占体积分数的变化规律。实验测知当Cl2所占体积分数为20%或60%时,反应后的总体积均为4L(气体体积均在相同条件下测得),则通过分析和计算求得化合物C的化学式可能为
(A)Cl2NO2 (B)NCl2O2 (C)NCl2O4 (D)NClO2
17、氧化铍陶瓷是一种导热性良好的陶瓷,对氧化铍而言,下列说法中,正确的是
(A)铍、氧离子电子层结构相同 (B)氧化铍不可能溶于烧碱溶液
(C)氧化铍可溶于硝酸 (D)氧化铍的熔点低于氧化钡
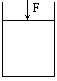 18、如右图所示,气缸上有一可自由移动,重量不计的活塞,缸内进行如下反应:N2(g)+3H2(g)
18、如右图所示,气缸上有一可自由移动,重量不计的活塞,缸内进行如下反应:N2(g)+3H2(g)![]() 2NH3(g);△H<0。如在活塞上加一大小为F的力,使平衡体系中各物质的浓度都增加为原来的n倍(n>1),则产生的结果是
2NH3(g);△H<0。如在活塞上加一大小为F的力,使平衡体系中各物质的浓度都增加为原来的n倍(n>1),则产生的结果是
①平衡向正方向移动 ②平衡体系中NH3的质量分数增加 ③正逆反应速率都增加 ④若保持活塞的位置不变,则力F减小 ⑤活塞向下移动
(A)①⑤ (B)①②⑤ (C)③④ (D)①②③④⑤
第Ⅱ卷(非选择题 共76分)
三、实验题(本题包括1小题,共16分)
19、(18分)“套管实验”是将一只小的玻璃仪器装入另一玻璃仪器里,经组装完成原来要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年来被广泛开发并应用于化学实验中。下列两个实验均为“套管实验”,请观察实验装置,分析实验原理,回答下列问题。
实验一:如图a,小试管内塞有沾有无水硫酸铜粉末的棉花球。
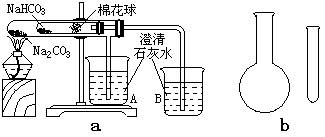
(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象是___________。
(2)整个实验结束时,在操作上要特别注意的问题是__________。
(3)通过该实验可以得出的结论是____________。
实验二:在氨气的喷泉实验中,将圆底烧瓶集满氨气的操作很麻烦。请设计一个简单的操作方法,只用一只试管(如图b),选用下列药品:(A)氯化铵固体 (B)氢氧化钠固体 (C)浓氨水 (D)浓硫酸 (E)湿润的红色石蕊试纸。采用“套管法”在圆底烧瓶中集满喷泉实验用的氨气。
(4)所用试剂为:_______。
(5)请简述所设计的操作及判定集满氨气的方法及现象________。
四、(本题包括两小题,共24分)
20、(12分)由短周期元素组成的电子数相等的四种离子A-、B+、C2+、D3+。已知A-与B+、C2+、D3+均成反应,其反应现象如下:
| B+ | C2+ | D3+ | |
| A- | 加热生成气体 | 生成白色沉淀 | 生成白色沉淀,当A-过量时沉淀消失 |
(1)写出A-的电子式_______。
(2)写出离子方程式:A-+B+_________________;A-+C2_________________;
A-(过量)+D3+_________________。
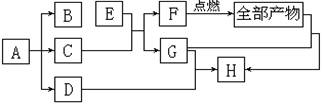 21、(12分)如图所示:A、E、H是白色固体,且H不溶于水;G是一种微溶于水的白色固体;B、D、F是无色气体,且B能使湿润的红色石蕊试纸变蓝;C在常温下呈液态。回答下列问题。
21、(12分)如图所示:A、E、H是白色固体,且H不溶于水;G是一种微溶于水的白色固体;B、D、F是无色气体,且B能使湿润的红色石蕊试纸变蓝;C在常温下呈液态。回答下列问题。
(1)A的化学式为________或_________。
(2)D的电子式是__________。
(3)写出E+C→F+G的化学方程式_________________。
 五、(本题包括2小题,共24分)
五、(本题包括2小题,共24分)
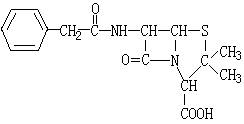
22、(10分)青霉素(C16H18N2O4S)的结构简式为:
它是人们经常使用的一种抗生素,但经过多年的使用,不少病菌对青霉素产生了抗药性,为此科学家又研制了一种新的青霉素----氨苄青霉素来代替青霉素。
下图是由青霉素制取氨苄青霉素的合成路线。
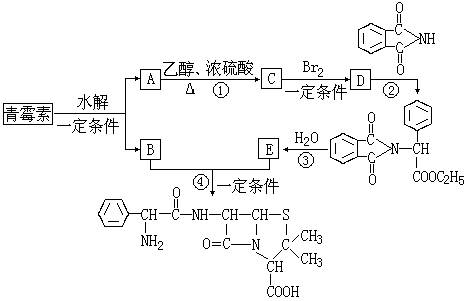
![]()
已知:有机物分子中和相连的碳原子称为α-碳原子,其上面连着的氢原子称为α-氢
原子, 在一定条件下,α-氢原子易被取代。请回答下列问题。
(1)从下列选项中,选出反应②、④所属的反应类型:②________,④_______。
(A)取代反应 (B)加成反应 (C)消去反应
(2)写出①、③的化学方程式。
反应①__________;反应③_______。
23、(8分)化合物A最早发现于酸牛奶中,它是人体内糖代谢的中间体,可由马铃薯、玉米淀粉等发酵制得,A的钙盐是人们常用的补钙剂之一。A在某种催化剂的存在下进行氧化,其产物不能发生银镜反应。在浓硫酸存在下,A可发生如下图所示的反应。
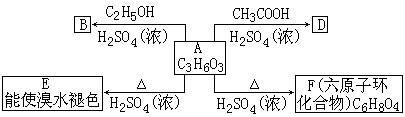
试回答下列问题。
(1)写出化合物的结构简式A___________、B___________、D___________。
(2)写出化学方程式:A→E___________,A→F___________。
反应类型:A→E___________,A→F___________。
六、(本题包括1小题,共12分)
24、(8分)在25℃,101kPa条件下,将15LO2通入10LCO和H2的混合气体中,使其完全燃烧,干燥后,恢复到原来的温度和压强。
(1)若剩余气体的体积是15L,则原CO和H2的混合气体中CO和H2各有几升?
(2)若剩余气体的体积为aL,则原CO和H2的混合气体中V(CO)∶V(H2)为多少?
(3)若剩余气体的体积为aL,则a的取值范围是什么?
第一学期
高三年级第三次考试化学试卷
第Ⅱ卷答卷纸
班级:高三( )姓名:________成绩:第Ⅰ卷___分 第Ⅱ卷___分 全卷_____分
| 得分 |
三、
19、(1)B中_______________________________________________________。
(2)C中____________,______________。E中________,________________;
(3)D中__________,______________________________________________。
(4)F中____________,______________________________,_______________。
(5)G中______________________,H中____________,_______________________。
20、(1)________________________。(2)__________,_________________________。
(3)_________________。(4)__________、__________。
| 得分 |
四、
21、(1)__________。
(2)_______________________________________________________。
(3)____________。
22、(1)X______,Y_______,Z_______,
(2)______________和_____________。
(3)____________________________________。
(4)____________,________________________。
(5)____________________________________。
| 得分 |
五、
23、(1)________>________;________>________。
(2)______,____。(3)__________。
(4)_______________________________。_______。
24、(1)A___________;D___________;
(2)①_____________________________________。②_________________;
(3)_____________________________;
| 得分 |
六、
25、
26、
(1)
(2)_____________。(3)_____________。
(4)
第一学期
高三年级第三次考试化学试卷
答案
一、 二、
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | D | B | B | B | D | B | A | D |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| AB | C | BC | CD | A | BC | A | B | D |
三、
19、(1)小试管内棉球变蓝,
(2)C中:饱和食盐水,除HCl。E中:浓硫酸,吸水。
(3)D中:红布条褪色,湿的Cl2中含有HClO。
(4)F中:有红棕色烟生成,Cu+Cl2![]() CuCl2,防止CuCl2颗粒进入导管。
CuCl2,防止CuCl2颗粒进入导管。
(5)G中:逐渐充满黄绿色气体。H中:NaOH溶液,2NaOH+Cl2=NaCl+NaClO+H2O。
20、(1)Be+2OH-=BeO22-+H2↑。(2) NaOH溶液,Be(OH)2+2OH-=BeO22-+2H2O。
(3)共价化合物。(4)Li2O、Li3N。
四、
21、(1)C元素。 (2)![]() 。(3)35.5g。
。(3)35.5g。
22、(1)碘,钠,氯, (2)Na2O和Na2O2。(3)2I-+Cl2=I2+Cl-。
(4)低,NaI离子键键能比NaCl弱。(5)![]() 。
。
五、
23、(1)CH4>NH3;H2S>HCl。(2)>,>。(3)CFCl3或CF3Cl。(4)破坏臭氧层。A。
24、(1)
(2)①H2S+OH-=HS-+H2O或H2S+2OH-=S2-+2H2O。②OH->S2-或OH->HS-;
(3)CH3OH CH3F CH3CH3等;
六、
25、(91.88%,14)
26、
(1)FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4
(2)7:1。(3)空气。(4)1000kg