高三年级第一学期第一次月考化学试卷
班级 姓名
有关原子量 Fe:56 S:32 N:14 H:1 O:16
第I卷(选择题,共48分)
一.单选题(每题6分,共48分)
1.下列各组物质气化或熔化时,所克服的微粒间的作用(力)属于同类型的是
A. 碘和干冰的升华 B. 二氧化硅和生石灰的熔化
C. 氧化钡和金属铁的熔化 D. 食盐和冰的熔化
2.下列说法正确的是
A.全部由非金属元素形成的化合物中只含有共价键
B.分子晶体的熔点较低,因为分子晶体中有化学键
C.金属在常温下都以晶体形成存在
D.金属晶体中,自由电子几乎均匀分布在整个晶体中,被许多金属离子共用
3.在强酸溶液中,下列各组离子能够大量共存的是
A. Mg2+、Ca2+、HCO3-、CI- B. Na+、AlO2-、Cl-、SO42-
C. K+、Fe2+、SO42-、Br- D. Fe2+、Ca2+、Cl-、NO3-
4.已知如下两个热化学方程式
C(s)+O2(g)===CO2(g);△H==-393.5kJ/mol
2H2(g)+O2(g)===2H2O(g);△H===-483.6 kJ/mol
现有0.2mol炭粉和氢气组成的悬浮气体、固体混合物在氧气中完全燃烧,共放出63.53kJ热量。则炭粉与氢气的物质的量之比是
A.1:1 B. l:2 C.2:3 D.3:2
5. FeCl3溶液和Fe(OH)3胶体具有的共同性质是:
A.滴人盐酸,先产生沉淀,然后沉淀又溶解 B.都能透过半透膜
C.都有丁达尔现象 D.加热蒸干灼烧,最终都有Fe2O3生成
6.在一定条件下,PbO2与Cr3+反应,产物是Cr2O72-和Pb2+,则与1mol Cr3+反应所需PbO2的物质的量为
A.3.0mol B. 1.5mol C.1.0mol D.0.75mol
7.下列反应的离子方程式正确的是
A.次氯酸钙溶液中通入过量二氧化碳
Ca2++2ClO-+H2O+CO2
= CaCO3¯+2HClO
B.硫酸亚铁溶液中加过氧化氢溶液
Fe2++2H2O2+4H+
=Fe3++4H2O
C.用氨水吸收少量二氧化硫
NH3·H2O+SO2=NH![]() +HSO
+HSO![]()
D.硝酸铁溶液中加过量氨水
Fe3++3NH3.H2O = Fe(OH)3¯+3NH![]()
8.pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是
A.NaOH B.H2SO4 C.AgNO3 D. CuSO4
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
第Ⅱ卷(非选择题,共60分)
三.填空题
9.(8分)0.3mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固
态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为
。又已知H2O(l)=H2O(g);△H=+44kJ·mol-1,
则11.2L标准状况下的乙硼烷完全燃烧生成气态水时放出的热量是
_________kJ。
10.(16分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电
解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
(1)
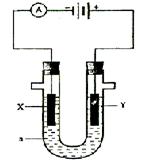 若X、Y都有是惰性电极,a是饱和NaCl溶液,
若X、Y都有是惰性电极,a是饱和NaCl溶液,
实验开始时,同时在两边各滴入几滴酚酞试液,则,
①电解池中X极上的电极反应式为 ,
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
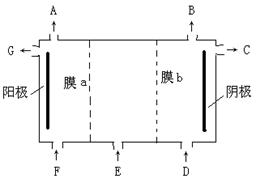 11.(18分)现有阳离子交换膜、阴离子交换膜、石墨电极,请用氯碱工业中的膜技术原理,回答下列问题。
11.(18分)现有阳离子交换膜、阴离子交换膜、石墨电极,请用氯碱工业中的膜技术原理,回答下列问题。
(1)阳离子交换膜在氯碱工业中的作
用是_______
写出用惰性电极电解硫酸钠水溶反应式
___________________ _。
(2)请利用交换膜技术,根据下图框架,设计一个电解硫酸钠溶液制氢氧化钠溶液和硫酸溶液的装置,标出进出物质名称。
A______ B______ _ C_______ D____ _ E______
F_____ _ G______ ,
膜b为_____ _ (填“阳离子交换膜”或“阴离子交换膜”)。
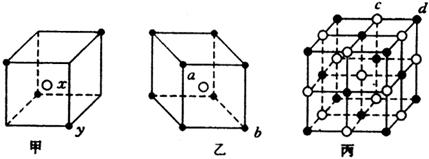
12.(8分)现有甲、乙、丙(如下图)三种晶体的晶胞:(甲中x处于晶胞中
心,乙中a处于晶胞中心)
可推知:甲晶体中x与y的个数比是 ,乙中a与b的个数比是 ,
丙晶体的一个晶胞中有 个c离子,有 个d离子。
四.计算题(10分)
13.用黄铁矿可以制硫酸,再用硫酸制取化肥硫酸铵。今燃烧含FeS2为80%的黄铁矿75吨,生产出79.2吨硫酸铵.若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制硫酸的损失率为多少?
答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | A | D | C | B | D | B | D | A |
9. B2H6(g)+3O2(g)=B2H3(s)+3H2O(l);△H=-2165kJ·mol-1 ; 1016.5
10、(1)①电解池中X极上的电极反应式为 2H+ + 2e- = H2 。
在X极附近观察到的现象是 放出气体,溶液变红 。
②Y电极上的电极反应式为 2Cl- +2e- =Cl2 ,检验该电极反应产物的方法是 把湿润的淀粉碘化钾试纸放在电极附近,试纸变蓝 。
(2)①X电极的材料是 纯铜 ,电极反应式为Cu2+ + 2e- =Cu 。
②Y电极的材料是 粗铜 ,电极反应式为 Cu-2e- =Cu2+ 。
11、①阳离子交换膜只能让阳离子通过。类推阴离子交换膜也应该只能让阴离子通过。
②氯碱工业中H2O参与放电而产生NaOH,
电解Na2SO4溶液时阴极区H+放电(阴极:2H+ + 2e-= H2↑)破坏水的电离平衡而使溶液呈
碱性,阳极区OH-放电(4OH-+4e-=2H2O + O2↑)破坏水的电离平衡而使溶液呈酸性。
③氯碱工业中为了得到纯净的NaOH产品,阴极区加入水(含少量NaOH增强导电荷性)。类
推:电解Na2SO4溶液要得到“纯净”的产品,在阴极区、阳极区也只能加入水,在电解池的中央部分加入Na2SO4溶液。
A:O2 B:H2 C:NaOH D:H2O(可含少量NaOH)
E:Na2SO4 F:H2O(可含少量H2SO4) G:H2SO4 膜b为阳离子交接膜。
12. 2:1, 1:1, 4,4
13. 33.3%