高三十月月考化学测试题
一、选择题
1.下列有关生活中的化学叙述不正确的是 ( )
A.氟里昂的继续使用会导致臭氧空洞加大 B.人体内摄入钙的量不足会导致骨质疏松
C.融化的雪水中矿物质含量比深井水多 D.α-氨基丁酸可预防老年痴呆症
2.只用一种试剂就可以鉴别醋酸铵、硫酸钠、硝酸镁、氯化铝和氯化铁溶液,这种试剂是( )
A.BaCl2 B.NaOH C.AgNO3 D.NH3·H2O
3.为制备干燥、纯净的Cl2,将二氧化锰和浓盐酸共热,所得气体先后通过装有下列物质两个吸收装置,两个装置中应依次装入的物质是 ( )
A.饱和食盐水;浓H2SO4 B.饱和NaHCO3溶液;无水CaCl2
C.浓H2SO4;饱和Na2CO3溶液 D.饱和Na2SO3溶液;碱石灰
4.已知0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量。表示上述反应的热化学方程式正确的是 ( )
A.![]() B2H6(g)+O2(g)=
B2H6(g)+O2(g)= ![]() B2O3(s)+H2O(l);△H=-649.5 kJ/mol
B2O3(s)+H2O(l);△H=-649.5 kJ/mol
B.B2H6(g)+3O2(g)=B2O3(s)+3H2O(l);△H=-2165 kJ/mol
C.B2H6(g)+3O2(g)=B2O3(s)+3H2O(g); △H=+2165 kJ/mol
D. B2H6+3O2=B2O3+3H2O; △H=+649.5 kJ/mol
5.浓度为0.5 mol/L 的某金属阳离子M2+的溶液10.00mL,恰好与0.40 mol/L的XO3n-溶液12.50 mL完全反应生成溶液,则X的化合价是 ( )
A.+1 B.+2 C.+3 D.+4
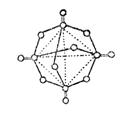 6.图所示为白磷在空气中充分燃烧的生成物分子的结构示意图。其中圆圈表示原子,实线表示化学键。下列关于该生成物的叙述中不正确的是 ( )
6.图所示为白磷在空气中充分燃烧的生成物分子的结构示意图。其中圆圈表示原子,实线表示化学键。下列关于该生成物的叙述中不正确的是 ( )
A.生成物的分子式为P4O10
B.分子中磷原子排列成正四面体型
C.单实线表示的化学键为极性键,双实线表示的为非极性键
D.生成物分子式为P4O6
7.在空气中CuI与汞蒸气化合可生成Cu2HgI4(其中Hg为+2价),在此反应中,CuI和Hg的物质的量之比为 ( )
A.2∶1 B.4∶1 C.2∶3 D.1∶4
8.现以c1和c2分别表示质量分数为a%和b%的稀硫酸的物质的量浓度,如果a∶b=1∶2,则下列推断正确的是 ( )
A.2c1=c2 B.2c2=c1 C.c2>2c1 D.c1<c2<2c1
9.下列说法正确的是 ( )
A.离子化合物中一定含有金属元素 B.构成分子晶体的粒子中一定含有共价键
C.构成原子晶体的粒子是相同或不同的原子 D.只有离子晶体中才存在离子
10.Na3N是离子化合物,它与水作用可产生氨气。下列叙述正确的是 ( )
A.Na3N与盐酸反应可产生两种盐 B.在Na3N与水反应中,Na3N作还原剂
C.Na3N中Na+离子半径比N3-离子半径小
D.Na+与N3-的电子层结构都与氩原子结构相同
11.下列各组离子在溶液中既可以大量共存,且加入过量氨水后也不产生沉淀的是( )
A.Na+、Ba2+、Cl-、SO42- B.K+、AlO2-、NO3-、OH-
C.H+、NH4+、 Al3+、SO42- D.H+、Cl-、CH3COO-、NO3-
12.将SO2通入BaCl2溶液至饱和未见沉淀生成,继续通入下列气体中的某种仍无沉淀生成,则该气体可能是 ( )
A.CO2 B.NH3 C.Cl2 D.NO2
13.能正确表示下列化学反应的离子方程式是 ( )
A.金属钠投入冷水中 2Na+2H2O=2Na++2OH-+H2↑ B.氨气通入稀硫酸中 NH3+H+=NH4+
C.氯化铁溶液中加入铁粉:Fe3+ +Fe=2Fe2+D.碳酸钙溶于硝酸中CO32-+2H+=CO2↑+H2O
14.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.2.7g金属铝变为铝离子时失去的电子数为0.1NA
 B.常温常压下,11.2 L氮气所含的原子数为NA
B.常温常压下,11.2 L氮气所含的原子数为NA
C.1.9 g H3+O离子中含有的电子数为NA
D.常温常压下,48 g O3含有的氧原子数为3NA
15.2、4、5—三氯苯氧乙酸是常见的除草剂,其结构式如下:
下列说法正确的是 ( )
A.该物质可以发生酯化反应 B.其分子式是C8H5Cl3O3
C.如果苯环上取代基的位置不变,则属于酯类的同分异构体有4种
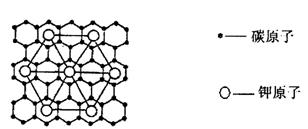 D.这种除草剂由于苯环的影响,导致了没有酸性
D.这种除草剂由于苯环的影响,导致了没有酸性
16.石墨能与熔融金属钾作用,形成石墨间隙化合物,K原子填充在石墨各层碳原了中。比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见右图,。则x值为
A. 8 B. 12
C. 24 D. 60
17.c(OH-)=10-1mol/L的强碱溶液与c(H+)=10-2mol/L的强酸溶液混,所得混合液的pH=11,则强碱和强酸的体积比是 ( )
A.11∶1 B.9∶1 C.1∶11 D.1∶9
18.将0.02 mol/L的HCl溶液与0.04 mol/L 的NaHS溶液等体积混合后,溶液显酸性,则下列关系式中正确的是 ( )
A.c(Na+)>c(Cl-) B.c(H2S)+c(HS-)+c(S2-)=0.02mol/L
C.c(H+)=c(Cl-) D.c(HS- )<c(H2S)
二.填空题
19.(8分) (1)白磷的着火点为40℃,在室温或夏天正常取出时,就可观察到其被氧化而冒”白烟”,请简单说明将如何将大块的白磷切变成小块的白磷。
(2)某学生在实验报告中写出以下的实验操作或实验数据,你认为合理的是 ( )
A.用托盘天平称取29.25g的食盐;B.用湿润的pH试纸测得某溶液的pH为10
C.将浓硫酸沿容器器壁缓缓地倒入酒精中,并不断搅拌;
D.用酸式滴定管量取已知浓度的KMn04溶液20.00mL;
E.做中和滴定实验时,锥形瓶用待测液润洗
20.(15分) 已知常温常压下CO2在水中的溶解度不大,CO2与NaOH溶液反应时没有明显现象,某研究小组同学,设计了下图A—E五套装置。欲利用这些装置,能通过观察现象,间接证明CO2与NaOH溶液发生了反应。
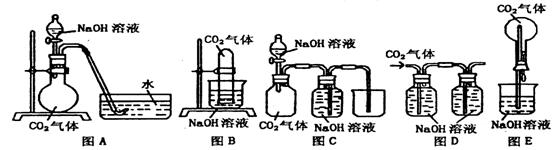
请选用以上实验装置,同时指出操作规程方法和观察到的实验现象,将答案填入下表:(表中已有一个示例)
| 所选装置 | 操作方法 | 实验现象 |
| B | 将充有CO2试管的橡皮塞打开 | 水槽中NaOH溶液上升到试管中 |
21.(7分)将Cl2通入足量浓NaOH和H2O2的混合溶液中,发生了一系列的化学反应,最后由于ClO-和H2O2发生反应而放出氧气,并伴随着有闪烁的红光出现。
(1)写出最后生成氧气的离子方程式
__________________________________ ___________.
(2)上述反应中被氧化的元素是__________________.
 (3)若反应中消耗了0.3 mol ClO-,则发生转移的电子数目是________________.
(3)若反应中消耗了0.3 mol ClO-,则发生转移的电子数目是________________.
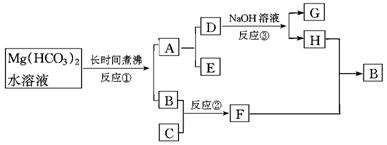
22.(18分)在下列物质间的转化关系中,反应③为电解,每个框中的字母只代表一种物质。试回答:
(1)A的化学式_ __.
(2)反应①的化学反应式,_________ ____;
简述能生成A物质的原因_ __.
(3)反应②的化学反应式_________ ____;
反应的现象是____ __.
(4)反应③中加入NaOH溶液的原因是____________________ ________________.
23.(8分)对A、B两种有机物的研究分别获取了如下信息:
①化合物A的相对分子质量小于300.
②在化合物A中ω(C)=71.58%,ω(H)=6.67% , ω(N)=4.91%,其余是氧元素.
③1 mol B水解得到1 mol A和2 mol醋酸.由此确定:(1)化合物A的相对分子质量为_________;化合物B和化合物A相对分子质量之差____ _____.
(2)化合物A的分子式为___________,化合物B的分子式为___________.
三.计算题
24.(10分)一定量的Fe和Fe2O3的混和物投入250 mL 2 mol/L 的硝酸溶液中,固体完全溶解后,收集到1.12 L NO(标况下)。欲使铁元素完全沉淀,问向反应后的溶液中加入1 mol/L NaOH溶液多少毫升?
25.(12分) 仔细分析下列各题后回答问题:
(1)高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g)![]() Fe(s)+CO2(g);(ΔH>0).①对上述反应,在由于升高温度而使化学平衡移动的过程中,高炉内CO2和CO的体积比_________(填“增大”“减小”或“不变”)。
Fe(s)+CO2(g);(ΔH>0).①对上述反应,在由于升高温度而使化学平衡移动的过程中,高炉内CO2和CO的体积比_________(填“增大”“减小”或“不变”)。
②在1100℃时,上述反应达到平衡后,测得CO2和CO的体积比为0.263.在该温度下,如果某时刻C(CO2)=0.025 mol/L、C(CO)=0.1 mol/L,在这种情况下,该反应是否处于化学平衡状态_________(填“是”或“否”);此时,其化学反应速率v(正)_____v(逆)(填“大于”、“小于”或“等于”),
其原因是__________________ ____.
(2)在真空密闭容器中,加入a mol PH4I固体,在一定温度下发生如下反应:
PH4I(s)
![]() PH3(g)+HI(g)
PH3(g)+HI(g)
4PH3(g)
![]() P4(g)+6H2(g)
P4(g)+6H2(g)
2HI(g)
![]() H2(g)+I2(g)
H2(g)+I2(g)
以上三反应建立平衡后,测得HI为b mol,I2(g)为c mol,H2为d mol,求
①平衡后,容器内P4(g)和PH3的物质的量(用代数式表示)分别为________、________.
②a,b,c三者的关系服从a>_________(填含b,c的代数式) b,c,d三者的关系服从b>_________(填含c,d的代数式)
③平衡后,增大压强,容器内n(I2)___________,n(PH4I)_________(填“增加”、“减少”、或“不变”
1.C 2、B 3、A 4、B 5、C D(因为n(M2+)=n(XO3n-),故n=2,由此可推得XO32-中X的化合价为+4)6、 CD 7、B 8、C(硫酸的密度大于1)9、C 10、AC 11、B
12、A(NH3的存在将促进SO32-的生成,而出现BaSO3;Cl2 、NO2的存在将使SO2氧化生成SO42-,而生成BaSO4) 13、AB 14、CD 15、BA 16、A 17、D (强碱的PH=13,强酸的PH=2,因为PH之和为15,故强碱和强酸的体积比按1:10混合时,混合液为中性,但题设条件为碱性。因此,强酸的体积应减少,故选D选项正确) 18、AB(由已知数据可知A正确;由S元素守恒和“等体积”混合可知,D正确)
19(1)3分,用镊子夹取白磷,在盛有水的水槽中切割(其它合理答案同样给分) (2) BC(4分:只选一个得2分,选两个且都正确得4分,多选不得分)
20、(15分)
| 所选装置 | 操作方法 | 实验现象 |
| B(1分) | 将充有CO2试管的橡皮塞打开(2分) | 水槽中NaOH溶液上升到试管中(1分) |
| C(1分) | 将分液漏斗中的NaOH溶液滴入烧瓶(2分) | 水槽中的水被吸入烧瓶中(1分) |
| D(1分) | 向左瓶中通入CO2气体(2分) | 右瓶中无气泡冒出(1分) |
| E(1分) | 将滴管中NaOH溶液挤入烧瓶中(2分) | 产生喷泉现象(1分) |
21、(6分)(每小题2分)(1)ClO- + H2O2 ═ Cl- + H2O + O2
(2)氧元素(3)3.612×1023
22、(12分)(1)Mg(OH)2(2分)
(2)Mg(HCO3)2 ![]() MgCO3 + CO2 + H2O
(1分) MgCO3 + H2O
MgCO3 + CO2 + H2O
(1分) MgCO3 + H2O ![]() Mg(OH)2 + CO2 (1分)Mg(OH)2 比 MgCO3 更难溶(2分)
Mg(OH)2 + CO2 (1分)Mg(OH)2 比 MgCO3 更难溶(2分)
(3)Mg + CO2 ![]() MgO + C (2分) 发出耀眼的白光(1分) 有黑色颗粒和白色粉末生成(2分)
MgO + C (2分) 发出耀眼的白光(1分) 有黑色颗粒和白色粉末生成(2分)
(4)增强水的导电性(1分)
23、(2分)(1)285(当A中的N原子数分别为1、2、3、4……时,计算A的相对分子质量。由A的相对分子质量小于300,确定N原子数为1)(2分)84(1分);
(2)C17H19NO3 (2分) C21H23NO5(2分)(先求出A的分子式是C17H19NO3,因为1molB水解得到1moA和2lmol醋酸,故B的分子式是C17H19NO3 + 2C2H4O2 – 2H2O ═ C21H23NO5。相对分子质量相差84)
24、根据题意可知,固体溶于硝酸后,原硝酸中的N原子以NO3-和NO的形式存在.(2分)
因此,最后溶液中n(NO3-)=250 mL×10-3L/mL×2mol/L-![]() =0.450 mol(2分)
=0.450 mol(2分)
当铁元素完全沉淀时,溶液中溶质是NaNO3
因此:n(NaOH)=n(NO3-)=0.450 mol(2分)
需要加入的NaOH溶液的体积为
V[NaOH(aq)]=![]() =0.450 L=450 mL(2分)
=0.450 L=450 mL(2分)
25、(1)①增大 不变(各1分)
② 否 大于(各1分)
因为![]() =0.25<0.263(1分) 平衡向正反应方向移动(1分)
=0.25<0.263(1分) 平衡向正反应方向移动(1分)
(2)①![]() (d-c);b+
(d-c);b+![]() ②b+2c;
②b+2c;![]() (d-4c) ③减少 增大(各1分,共6分)
(d-4c) ③减少 增大(各1分,共6分)