高一化学![]()
 第一学期期中考试试卷
第一学期期中考试试卷
(新课标·苏教版)
说明:1.考试形式:闭卷 试题共五大题27小题,分值:100分,考试时限:100min;2.本卷可能用到的相对原子质量:H:1 He:4 Na:23 Mn:55 C:12 O:16 S:32 Cl:35.5
一、选择题(本题包括20小题,每小题2分,共40分。每题只有一个选项符合题意,请把答案填入对应的答题卡中。)
1.以下命题,违背化学变化规律的是
A、石墨制成金刚石 B.用无机物NH4CNO合成有机物CO(NH2)2
C.水(H2O)变成汽油(CxHy) D.将某种导体转变成绝缘体
2.KHSO4在水溶液中能够电离出H+、K+、和SO42- 。下列对于KHSO4的几种分类中不正确的是
A.KHSO4是盐 B.KHSO4是钾盐 C.KHSO4是酸 D.KHSO4是酸式盐
3.下图是制取蒸馏水的气化装置部分,安装时温度计的位置正确的是
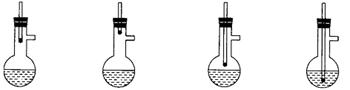
A. B. C. D.
4.在日常饮用水中添加含镁、钙、硒、锌等的矿物质,可以改善人体营养失衡,增强体质。其中的“钙、镁、锌、硒”是指
A.原子 B.离子 C.分子 D.元素
 5.原子结构模型的演变图中,⑴为道尔顿实心球式原子模型、⑵为卢瑟福行星运转式原子模型、⑶为汤姆生葡萄干面包式原子模型、⑷为近代量子力学原子模型、⑸为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是
5.原子结构模型的演变图中,⑴为道尔顿实心球式原子模型、⑵为卢瑟福行星运转式原子模型、⑶为汤姆生葡萄干面包式原子模型、⑷为近代量子力学原子模型、⑸为玻尔轨道式原子模型。其中符合历史演变顺序的一组排列是
A.⑴⑶⑵⑸⑷ B.⑴⑵⑶⑷⑸ C.⑴⑸⑶⑵⑷ D.⑴⑶⑸⑷⑵
6.下列物质中,不能导电的是
A.氯化钾溶液 B.澄清石灰水
C.酒精 D.石墨碳棒
7.下列物质与其用途相符合的是①KAl(SO4)2-做净水剂 ②AgBr—制胶卷,感光纸 ③Na、K合金—快中子反应堆热交换剂 ④AgI—人工降雨 ⑤淀粉—检验I2的存在 ⑥NaClO—漂白纺织物
A.②③④⑤⑥ B.①②③④⑤ C.②③④⑤ D.全部
8.固体可以分为晶体和非晶体,后者没有固定熔点。下列固体中,没有固定熔点的是
A.氢氧化钠 B.玻璃 C.冰 D.钠
9.下面是某加碘食盐包装袋上的部分图表文字(I为碘元素符号)。由此,你得到的信息和作出的推测是
 |
A.人体不能缺碘,需要正常补碘。“加碘食盐”中的“碘”是指碘单质
B.该食盐商品是以海盐为原料,经人加工后的产品,是盐类的纯净物
C.1kg此食盐中含碘酸钾(35±15)mg
D.“菜未烧熟不宜加入加碘盐”的原因可能是碘酸钾受热不稳定
10.将氯气通过软管灌入田鼠洞中,可以消灭田鼠,这是利用了氯气以下性质中的:①黄绿色 ②密度比空气大 ③有毒 ④较易液化 ⑤能溶解于水
A.①②③ B.②③ C.③④ D.③④⑤
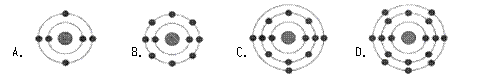 11.已知最外层电子数相等的元素原子具有相似的化学性质。氟原子的核外电子分层排布示意图为
11.已知最外层电子数相等的元素原子具有相似的化学性质。氟原子的核外电子分层排布示意图为![]() ,下列原子中,与氟原子的化学性质相似的是
,下列原子中,与氟原子的化学性质相似的是
12.下列说法正确的是
A.摩尔是国际单位制中七个基本物理量之一
B.1 mol OH-的质量是17 g/mol
C.NaOH的摩尔质量为40 g
D.1mol普通H2O中含有8mol中子
13.下列各组物质,仅用蒸馏水不能鉴别的一组是
A.煤炭粉、二氧化锰、氧化铜三种黑色粉未
B.汽油、酒精、四氯化碳
C.蔗糖、无水硫酸铜粉末、碳酸钙粉末
D.食盐、生石灰、硝酸铵
14.在下述各种分离方法中,适用于对微量物质分离的是
A.蒸馏法 B.过滤法 C.纸上层析法 D.萃取法
15.下图是表示物质分子的示意图,图中“●”和“○”分别表示两种含有不同质子数的原子,则图中表示属于纯净物单质的是
 |
16.钠与水反应时可能产生的各种现象如下:①钠浮在水面上; ②钠沉在水底; ③钠熔化成闪亮的小球; ④小球迅速四处游动,发出嘶嘶的声音; ⑤小球逐渐减小,最后消失;⑥滴入酚酞后溶液显红色。其中完整的正确组合是
A.①③④⑤⑥ B.②③④⑤⑥ C.①③④⑤ D.全部
17.以NA为阿伏加德罗常数的值,下列说法正确的是
A.分别由NA个水分子组成的冰、水、水蒸气的质量各不相同
B.1 mol O2的质量等于2NA个氧原子的质量之和
C.标准状况下,11.2L的水中含有0.5NA个H2O分子
D.1mol黄豆中含有NA个黄豆豆粒
18.现有下列各组气体,其中分子数一定相同的是
A.34g NH3和4g H2 B.11.2L N2和0.5mol N2
C.2L CO2和2L H2O D.14g N2和16g O3
![]() 19.水在下列反应中,只作为还原剂的是:
19.水在下列反应中,只作为还原剂的是:
A.2K + 2H2O = 2KOH + H2↑ B.2H2O 2H2↑ + O2↑
C.2F2 + 2H2O = 4HF + O2↑ D.Na2O + H2O = 2NaOH
20.胶体区别于其它分散系的本质特征是:
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.分散质粒子直径在10-9~10-7m之间
C.产生丁达尔现象
D.胶体是纯净物,其它分散系是混合物
|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
一、选择题(本题包括20小题,每小题2分,共40分,每小题只有一个正确答案)
|
二、填空题(本题共2小题,共16分)
21.(10分)请选用下列物质:Fe、Cl2、KI溶液、HClO、NaOH溶液,写出符合下列要求的化学方程式。并请在⑴⑵两个反应方程式中标出电子转移方向与数目。
![]() ⑴既是化合反应又是氧化还原反应:
⑴既是化合反应又是氧化还原反应:
![]() ⑵属于溶液中的置换反应:
⑵属于溶液中的置换反应:
⑶既是分解反应又是氧化还原反应: 。
⑷Cl2在反应中既被还原又被氧化: 。
22.(6分)下列几种单个微粒:①D2分子、 ②He原子、 ③α粒子(![]() α2+)、 ④质子、 ⑤中子、 ⑥电子、 ⑦夸克。 其中体积最小的微粒是 ;(用序号填空,下同)质量完全相同的微粒是
;带正电荷的粒子(不考虑夸克)是
。
α2+)、 ④质子、 ⑤中子、 ⑥电子、 ⑦夸克。 其中体积最小的微粒是 ;(用序号填空,下同)质量完全相同的微粒是
;带正电荷的粒子(不考虑夸克)是
。
|
三、推断填空题(本题共2小题,共14分)
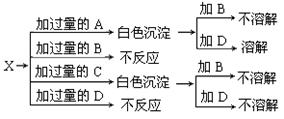 23.(4分)只用一种X溶液就可以区分A、B、C、D四种溶液,四种溶液分别是NaNO3、NaOH、HNO3和Ba(NO3)2 。请根据如图所示的方法,将它们依次确定。
23.(4分)只用一种X溶液就可以区分A、B、C、D四种溶液,四种溶液分别是NaNO3、NaOH、HNO3和Ba(NO3)2 。请根据如图所示的方法,将它们依次确定。
X: ,A: ,B: ,C: 。
24.(10分)目前我国工业上大多采用阳离子交换膜法电解食盐水制取NaOH和Cl2。电解槽如图所示。电解槽中用石墨或钛作阳极与电源正极相接,用铁网作阴极与电源负极相接,中间设特殊的阳离子交换膜。试分析:
⑴从A进入的液体是 ,从B流出的液体是 ;
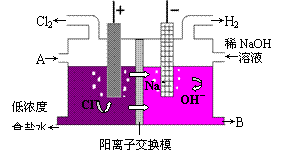 ⑵图中的离子交换膜只允许
⑵图中的离子交换膜只允许
离子通过,该离子交换膜还可以防止阴、
阳极产生的气体通过,因而可以避免
,又
能避免
。
⑶你认为这种制碱的方法存在的缺点是_________ (填序号)
A、消耗大量的电能 B、生产过程中若处理不当易造成环境污染
C、食盐不易获取 D、产品中H2和Cl2用途不大,造成浪费
|
四、实验题(本题共2小题,共16分)
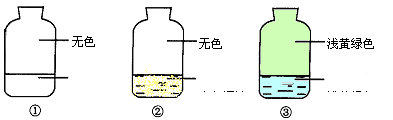 25.(6分)向盛有Cl2的三个集气瓶中,分别注入约四分之一的下列液体并振荡,观察下图所记录的现象,判断各瓶注入的液体是什么,将注入液体的编码填入图下方相应的括号中。A、饱和石灰水 B、AgNO3溶液 C、水
D、NaBr溶液
25.(6分)向盛有Cl2的三个集气瓶中,分别注入约四分之一的下列液体并振荡,观察下图所记录的现象,判断各瓶注入的液体是什么,将注入液体的编码填入图下方相应的括号中。A、饱和石灰水 B、AgNO3溶液 C、水
D、NaBr溶液
( ) ( ) ( )
26.(10分)实验室需要250mL 0.5mol/L的稀硫酸溶液,现用密度为1.84g/mL,质量分数为98%浓硫酸配制。填空并请回答下列问题:
⑴下列仪器中,不会用到的是
A.250mL容量瓶;B.500mL容量瓶;C.50mL量筒;D.10mL量筒;E.玻棒;
⑵若要实施配制,除上述仪器外,尚缺的仪器或用品是 。
⑶容量瓶上除有刻度线和容量规格外还应标有 ,容量瓶在使用前必须进行的操作是 。
![]() ⑷人们常将配制过程简述如下:其正确的操作顺序是
(填各
⑷人们常将配制过程简述如下:其正确的操作顺序是
(填各
步骤序号)。A.冷却;B.洗涤;C.量取;D.溶解;E.定容;F.摇匀;G.移液
⑸若配制过程中,向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,应如何处理?
|
五、计算题(本题共14分)
27.实验室使用的浓盐酸的质量分数一般为36.5%,密度为1.19g·cm-3。试问:
⑴1.00L溶液溶解多少L标准状况下的HCl气体,可得此浓度的浓盐酸?(4分)
⑵该浓盐酸对应的物质的量浓度为多大?(4分)
⑶在加热的条件下,用MnO2与此浓盐酸反应,制得标准状况下Cl2 0.56L,被氧化的HCl的物质的量是多少?(6分)
【原创命题 张 军·校对 曹宏宇】
第一学期期中考试
高一化学试卷参考答案(新课标·苏教版)
一、选择题(本题包括20小题,每小题2分,共40分,每小题只有一个正确答案)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | C | A | D | A | C | D | B | D | B |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
| D | D | A | C | B | A | B | A | C | B |
![]() 二、填空题(本题共2小题,共16分)
二、填空题(本题共2小题,共16分)
![]()
![]()
![]() 21.⑴2Fe+3Cl2
2FeCl3 (3分) ⑵ Cl2+2KI
== 2KCl + I2
(3分)
21.⑴2Fe+3Cl2
2FeCl3 (3分) ⑵ Cl2+2KI
== 2KCl + I2
(3分)
⑶2HClO 2HCl+O2↑(2分) ⑷Cl2+2NaOH == NaCl+NaClO+H2O (2分)
注:方程式中的物质超出备选物的不给分;⑴和⑵的反应式、转移方向和电子数目各1分;各反应式若不配平的分别扣1分。
22.⑦;(2分) ①②;(2分) ③④(2分)
三、推断填空题(本题共2小题,共14分)
23.MgSO4;NaOH;NaNO3;Ba(NO3)2(每空1分,共4分)
24.⑴精制饱和食盐水(2分),NaOH溶液(2分); ⑵Na+、H+ (2分);Cl2和 H2混合而引起爆炸(1分),Cl2和NaOH作用生成NaClO(1分); ⑶ AB(2分)
四、实验题(本题共2小题,共16分)
25.①A(2分) ②B(2分) ③C(2分)
26.⑴B.C;(2分) ⑵烧杯、胶头滴管;(2分) ⑶使用的温度 检查水密性;(2分) ⑷C D A G B E F;(2分) ⑸宣告实验失败,洗净容量瓶后重新配制;宣告实验失败,洗净容量瓶后重新配制。(2分)
五、计算题(本题共14分)
⑴![]() ×36.5%;(HCl)=266.56L
×36.5%;(HCl)=266.56L
(4分)
⑵![]() (4分)
(4分)
![]() ⑶由反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(1分) 知,被氧化的HCl与产生的Cl2的关系如下: 2HCl ~ Cl2
(1分)
⑶由反应MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O(1分) 知,被氧化的HCl与产生的Cl2的关系如下: 2HCl ~ Cl2
(1分)
![]()
解得:n(HCl)=0.05mol (4分)
答:略
【答案提供人:张 军】