高三化学有机反应类型铁 无机框图推断
 双基知识:
双基知识:
Fe2O3 FeCl3 Fe(OH)3
Fe(NO3)3 Fe FeCl2 Fe(OH)2
Fe
Fe(NO3)2 FeSO4
巧思巧解:
1.Fe(OH)2 制取
Fe(OH)2 极易被氧化,溶解在水中的少量O2都能将它氧化成Fe(OH)3 ,所以按一般方法很难得到Fe(OH)2白色沉淀。因此实验室中要解决的主要矛盾是防止Fe2+ 和Fe(OH)2被氧化。可采取的措施主要是:①采用新制备的纯亚铁盐溶液;②将溶解亚铁盐的蒸馏水煮沸除氧气;③在亚铁盐溶液表面加隔氧剂,如油或苯;④将碱直接加到亚铁盐溶液底部,使Fe(OH)2生成于溶氧少的部位。⑤通入不参加反应的气体排除空气,在此气氛中滴加强碱。
2.常见与铁或铜及其化合物的颜色相同或相近的物质
红 : Fe2O3 Fe(OH)3 Fe(SCN)3 Cu2O Cu NO2 Br2(g)
黄 : Fe3+ 的溶液 Na2O2 S AgI AgBr Ag3PO4 Cl2 (黄绿)
绿 : Fe2+ 的溶液 FeSO4·7 H2O Cu2(OH)2CO3
紫 : ( Fe3+ 与苯酚作用的溶液) KMnO4 I2
黑 : Fe3O4 FeO FeS MnO2 CuO Cu2S CuS
白 : Fe(OH)2 Fe(银白) Al(OH)3 Mg(OH)2 BaCO3 BaSO4 AgCl
蓝 : Cu2+ 的溶液 CuSO4·5H2O
3.常见物质的反应现象
(1)火焰的颜色
a.H2在Cl2中燃烧:苍白色 b.CO、H2、CH4 在空气中燃烧:蓝色 淡蓝色
c.钠元素焰色反应:黄色(物理变化)
d.钾元素焰色反应:浅紫色(透过蓝色钴玻璃,物理变化)
(2有烟、雾或烟雾的现象
a.空气中出现白雾:HCl、HBr、HI、NH3、HNO3
b.空气中出现白烟:NH3与(HCl、HBr、HI、HNO3)
c.燃烧出现白色烟雾:P+Cl2
d. 燃烧出现棕黄色烟: Cl2 与(Cu 、Fe )
(3)沉淀颜色变化
Fe2+ (含Fe2+的溶液)遇碱液,沉淀颜色转变:白色变灰绿色变红褐色
(4)先有沉淀后沉淀消失
a.CO2或SO2通入澄清石灰水中, b. H3PO4 溶液滴入澄清石灰水中,
c. 含Al3+ 的盐溶液中滴入强碱溶液, d. 含AlO2― 的盐溶液中滴入强碱溶液.
(5) 具有唯一性的现象
a. 溶于水显碱性且遇湿的红色石蕊试纸变蓝的气体唯有NH3
b. 在空气中迅速由无色变为红棕色的气体唯有 NO
c. 在一定条件下能漂白有色物质的淡黄色固体唯有Na2O2
d. 在空气中能自燃的固体唯有 白磷
e. 遇SCN- 显红色的唯有Fe3+ ,遇OH― 生成红褐色沉淀的唯有Fe3+
f. 可溶于NaOH溶液的白色沉淀是Al(OH)3 ,
可溶于NaOH溶液的金属氧化物是Al2O3 。Zn(OH)2 、ZnO 不作要求。
g. 可溶于氢氟酸的酸性氧化物唯有SiO2
h.在冷的浓H2SO4或冷的浓HNO3中产生钝化现象的唯有Fe 和Al
i.同一元素的气态氢化物和最高价氧化物的水化物化合生成盐的元素唯有N元素。
(6)FeCl3 变色实验知多少
①向FeCl3 溶液中滴加几滴KSCN 溶液呈红色。
②FeCl3 溶液能使石芯试液呈红色。
③FeCl3 与NaOH 溶液反应,生成红褐色沉淀。
④向FeCl3 溶液中通入H2S 气体,生成淡黄色沉淀。
⑤向FeCl3 溶液中滴加几滴Na2S 溶液,生成淡黄色沉淀;当加入Na2S 溶液过量时,又生成黑色沉淀。
⑥向FeCl3 溶液中加入过量的铁粉,溶液变浅绿色。
⑦向FeCl3 溶液中加入过量的铜粉,溶液变蓝绿色。
⑧将FeCl3 溶液滴加到淀粉KI 溶液中,,溶液变蓝色。
⑨向FeCl3 溶液中加入苯酚溶液,溶液变紫色。
⑩将FeCl3 溶液滴加到AgNO3 溶液中,,有白色沉淀生成。
⑾将FeCl3 溶液与NaHCO3 溶液混合,放出气体,生成红褐色。
⑿将饱和FeCl3 溶液滴入沸水中,生成红褐色Fe(OH)3 。
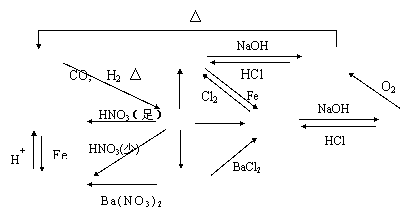
4.无机框图题
![]()
![]()
![]() 无机框图题的一般解题思路是:迅速游览 产生印象 寻找突破口 注意联系
无机框图题的一般解题思路是:迅速游览 产生印象 寻找突破口 注意联系
![]()
![]()
![]() 大胆设想 全面分析(正推和逆推) 验证确认。
大胆设想 全面分析(正推和逆推) 验证确认。
解题的关键是:依物质的特征或变化特征来确定“突破口”,顺藤摸瓜,进而完成全部未知物的推断。因此应熟练掌握以Na 、Al、Fe 等金属为代表,非金属以S、Cl、N、C等为代表的元素及化合物相互转化的基础知识。
5.金属活动性顺序表的应用
(1)判断金属与酸反应的产物
a 氢以前的金属能置换出非氧化性酸中的氢
2Al+3H2SO4=Al2(SO4)3 +3H2
b 氢以后的金属不能跟非氧化性酸反应,只能跟强氧化性酸反应
3Cu +8HNO3 (稀)=3 Cu(NO3)2 + 2NO +4 H2O
c 氢以前的金属与氧化性酸反应的产物与金属活泼性、酸的浓度、温度等多种因素有关。
d Fe、Al在冷的浓H2SO4 、浓HNO3 中钝化
(2)判断金属与盐溶液反应的产物
a 除活泼金属(K、Ca、Na、Mg、Ba等)外,前面的金属能将后面的金属从其盐溶液中置换出来:Fe+CuSO4 =FeSO4+Cu
b 后面的金属也可与前面的金属离子发生氧化还原反应:2Fe3++Cu =2Fe2++Cu2+
c 其它情况:3Zn +2FeCl3 + 6H2O =2Fe(OH)3 ↓+3ZnCl2 +3H2 ↑
(3)判断金属与水反应的产物
a K、Ca Na 遇冷水迅速反应放出H2
b Mg 在冷水中反应缓慢,在沸水中反应快
c Al 在冷水中不反应,在沸水中反应微弱
d Zn、Fe、Sn、Pb能在红热的条件下与水蒸气反应,产生H2 。
3Fe+4H2O (g)= Fe3O4 + 4H2
e 氢以后的金属不与H2O 反应
(4)判断原电池的电极和电极反应式:活泼的金属作负极,失去电子,发生氧化反应。
(5)判断电解时阴极阳离子放电顺序:
Ag+ >Fe3+ >Hg2+>Cu2+ >H+ >Pb2+>Sn2+>Fe2+ >Zn2+>(H+ )>Al3+ >Mg2+ >Na+ >Ca2+ >K+
(6)判断金属原子还原性和金属离子氧化性的大小
a 金属原子的还原性:K→Ag 逐渐减弱
b 金属离子的氧化性:K+→Ag+ 逐渐增强
(7)判断金属冶炼的方法
a K→Al 熔融电解
b Zn →Cu 用还原剂C、CO、H2 或熔融电解
c Hg →Ag 加热其氧化物
d Pt 、Au 物理方法
(8)判断不溶性碱热稳定性的大小
规律:金属越活泼,其氢氧化物越不易分解
a KOH、NaOH、Ca(OH)2,1000℃以上
b Mg 至Cu 酒精灯加热
c Ag、Hg常温下分解
d Pt、Au无氢氧化物
(9)判断可溶性碱的碱性强弱
规律:金属越活泼,其氢氧化物的碱性越强
(10)判断单质能否与O2反应及其产物
a K到Na 常温下易氧化
b Mg 到Fe常温下可氧化,加热易氧化
c Sn 到Ag 高温下氧化
d Pt、Au不氧化
(11)判断金属元素在自然界中的存在状态
a K到Pb化合态
b Cu、Hg、Ag化合态和游离态
c度Pt、Au游离态
(12)判断金属氧化物的水化情况
a K到Mg 能与水反应
b Al到Au 不作用
例题精析
【例1】已知 2Fe2+ +Br2 = 2Fe3+ +2Br― ,若向100mL的FeBr2溶液中通入标准状况下的Cl2 3.36L,测得形成的溶液中Cl― 和Br― 的物质的量浓度相等,则原FeBr2 溶液的物质的量浓度为 ( )
A.0.75mol/L B.1.5mol/L C.2 mol/L D.0.3mol/L
【例2】Fe和 Fe2O3的混合物,加入稀H2SO4溶液 100mL,放出H2 1.68L(标准状况)。Fe和 Fe2O3 均无剩余,向溶液中滴入KSCN溶液,未见颜色改变。为了中和过量的H2SO4,并使FeSO4 全部转化为Fe(OH)2 ,恰好消耗了3mol/L的NaOH溶液200mL,试求原硫酸溶液的物质的量浓度。
【例3】 X、Y、Z为常见的三种单质,常温下X是固体,Y是液体,Z是无色气体。其反应关系如图所示,其中B的溶液显强酸性。
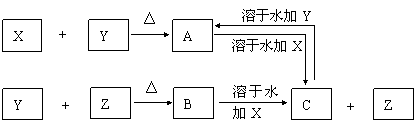
请回答下列问题:
(1)根据上述关系,确定X、Y、Z的化学式:X ,Y ,Z 。
(2)Y在元素周期表中的位置为 周期 族。
(3)写出A溶于水后加入X的离子方程式: 。
(4)写出C的溶液中通入过量Cl2的离子方程式: 。
【例4】X、Y、Z、W四种元素都位于周期表中的短周期,且原子序数X<Y<Z<W。X原子和Y原子的最外层电子数之和与Z原子最外层电子数相等;X的原子半径是自然界元素中原子半径最小的;W原子和Y原子的最外层电子数之和为Z原子最外层电子数的2倍,W原子最外层电子数为其电子层数的3倍。
(1)这四种元素的名称分别是X ,Y ,Z ,W 。
(2)写出由上述四种元素组成的既能与盐酸反应,又能与NaOH溶液反应的常见物质的化学式(各写一种)。无机物 ,有机物 。
(3)A、B、C、D分别是由X、Z、W中二种元素组成的常见的含有相同电子数的分子或离子,其中A是由5个原子组成,它们之间有如图所示的反应关系:
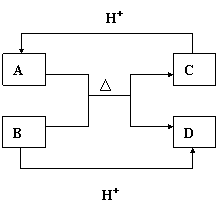 ①A、B的电子式分别为:
①A、B的电子式分别为:
A ,B 。
B、C、D三种粒子结合质子的能力:
> > (用粒子符号表示),
其理由是
。
答案:例1 、C
例2、C(H2SO4)=3mol/L
例3、(1)X:Fe ;Y:Br2 ;Z:H2
(2)第4周期、ⅦA族
(3)2Fe3+ +Fe =3Fe2+
(4)2Fe2+ +4Br― +3Cl2 =2Fe3+ +2Br2
例4、(1)X、氢,Y、碳,Z、氮,W、氧
(2)无机物: (NH4)2CO3 或NH4HCO3
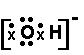 有机物:CH3COONH4
或CH2(NH2)COOH
有机物:CH3COONH4
或CH2(NH2)COOH
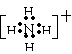 (3)① A、
,B、
(3)① A、
,B、
② OH― >NH3 >H2O
理由: OH― + NH4+ = NH3 ↑+H2O
NH3 + H3O+ = NH4+ +H2O