高三化学预测模拟试题
可能用到的相对原子质量:Cu:64 O:16 S:32 N:14 I:127 C:12 H:1
第Ⅰ卷(选择题,共64分)
一、选择题(本题包括16小题,每小题4分,共64分。每小题只有一个选项符合题意。)
1.下列物质一定不是天然高分子的是( )
A.橡胶 B.蛋白质 C.尼龙 D.纤维素
2.上海环保部门为了使城市生活垃圾得到合理利用,近年来逐步实施了生活垃圾分类投放的办法。其中塑料袋、废纸、旧橡胶制品等属于( )
A.无机物 B.有机物 C.盐类 D.非金属单质
3.以![]() 表示阿伏加德罗常数,下列说法中正确的是( )
表示阿伏加德罗常数,下列说法中正确的是( )
A.53g碳酸钠中含![]() 个
个![]() B.0.1mol
B.0.1mol![]() 含
含![]() 个电子
个电子
C.1.8g重水(![]() )中含
)中含![]() 个中子 D.标准状况下11.2L臭氧中含
个中子 D.标准状况下11.2L臭氧中含![]() 个氧原子
个氧原子
4.下列电子式中错误的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.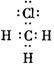
5.在医院中,为酸中毒病人输液不应采用( )
A.0.9%氯化钠溶液 B.0.9%氯化铵溶液 C.1.25%碳酸氢钠溶液 D.5%葡萄糖溶液
6.随着人们生活水平的提高,小汽车已进入平常百姓家。为了保护行驶人员的安全,常备有防撞气囊,内装有能在撞车后10ms(1ms=![]() s)内发生爆炸性反应的物质
s)内发生爆炸性反应的物质![]() ,化学方程式为
,化学方程式为![]() ,驾驶员可在汽车遭撞击后受气囊保护而脱险。此外,气囊内还装有陶土、
,驾驶员可在汽车遭撞击后受气囊保护而脱险。此外,气囊内还装有陶土、![]() 粉等物质,以使气囊内产生的
粉等物质,以使气囊内产生的![]() 在100ms~200ms内消失,同时气囊内的Na变为
在100ms~200ms内消失,同时气囊内的Na变为![]() 。下列说法中不正确的是( )
。下列说法中不正确的是( )
A.在1mol![]() 离子中共含有16mol电子
离子中共含有16mol电子
B.配方中,![]() 与
与![]() 的物质的量之比应在6∶1左右
的物质的量之比应在6∶1左右
C.气囊内![]() 迅速消失的目的是在撞车时不致使人反弹
迅速消失的目的是在撞车时不致使人反弹
D.气囊的保护作用是通过延长作用时间实现的
7.![]() 是常见的大气污染物之一,我国规定空气中
是常见的大气污染物之一,我国规定空气中![]() 含量不得超过0.02mg/L。下列措施能够减少
含量不得超过0.02mg/L。下列措施能够减少![]() 排放量的是( )
排放量的是( )
①用天然气代替煤炭做民用燃料 ②提高热能利用率 ③硫酸厂采用更好的催化剂使![]() 转变成
转变成![]() ④使用
④使用![]() 作萃取剂除去煤炭中的硫 ⑤燃烧煤中加入石灰石后使用
作萃取剂除去煤炭中的硫 ⑤燃烧煤中加入石灰石后使用
A.全部 B.①②⑤ C.①③⑤ D.①③④
8.限用硝酸、硫酸、盐酸、醋酸和钠盐、钾盐、钡盐相互反应符合离子方程式![]() 的化学方程式个数有( )
的化学方程式个数有( )
A.6 B.8 C.12 D.16
9.向2mL 0.5mol·![]() 的
的![]() 溶液中加入3mL 5mol·
溶液中加入3mL 5mol·![]() KF溶液,发现
KF溶液,发现![]() 溶液渐渐褪至无色,再加入KI溶液和
溶液渐渐褪至无色,再加入KI溶液和![]() 振荡后,静置,不见
振荡后,静置,不见![]() 层有紫红色,则下列说法正确的是( )
层有紫红色,则下列说法正确的是( )
A.![]() 不与
不与![]() 发生反应 B.
发生反应 B.![]() 与
与![]() 结合成不与
结合成不与![]() 反应的物质
反应的物质
C.F-使![]() 的还原性减弱 D.
的还原性减弱 D.![]() 被F-还原为
被F-还原为![]() ,使溶液中不再存在
,使溶液中不再存在![]()
10.欲从苯酚的乙醇溶液中回收苯酚,下列操作顺序合理的是( )
①蒸馏 ②过滤 ③静置分液 ④加入足量金属钠 ⑤加入足量的苛性钠溶液
⑥通入过量![]() 气体 ⑦加入足量的三氯化铁溶液 ⑧加入乙酸与浓
气体 ⑦加入足量的三氯化铁溶液 ⑧加入乙酸与浓![]() 混合加热
混合加热
A.④⑥③ B.⑧① C.⑤①⑥③ D.⑧②⑥③
11.扑热息痛是一种优良的解热镇痛药,结构式为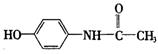 下列说法中正确的是( )
下列说法中正确的是( )
A.它不与烧碱溶液反应 B.它不能与浓溴水发生取代反应
C.它不能被氧化剂氧化 D.遇![]() 溶液发生显色反应
溶液发生显色反应
12.一种新型燃料电池,它是用两根金属做电极插入KOH溶液中,然后向两极上分别通甲烷和氧气,其电池反应为:
X极:![]()
Y极:![]()
下列关于此燃料电池的有关说法中错误的是( )
A.通过甲烷的电极(X)为电池的负极,通过氧气的电极(Y)为电池正极
B.放电一段时间后,电解质溶液中KOH的物质的量改变
C.在标准状况下,通过5.6L氧气,完全反应后有1.0mol的电子发生转移
D.放电时,通过甲烷的一极附近的pH升高
13.甲、乙两个相同的电解槽,如图所示连接a,b,c,d均为铂电极,通电后发现a极板处有气体放出,c极板质量增加,则以下说法中正确的是( )
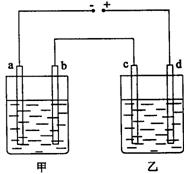
A.甲槽中溶液是![]() ,乙槽中溶液是NaOH B.甲槽中溶液是NaOH,乙槽中溶液是
,乙槽中溶液是NaOH B.甲槽中溶液是NaOH,乙槽中溶液是![]()
C.甲槽中溶液是![]() ,乙槽中溶液是
,乙槽中溶液是![]() D.甲槽中溶液是
D.甲槽中溶液是![]() ,乙槽中溶液是
,乙槽中溶液是![]()
14.实验室合成氨装置如图所示,则以下说法中错误的是( )
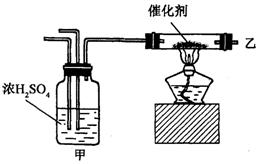
A.装置甲的作用是干燥
B.装置甲的作用是化合
C.乙处导出的气体是![]() ,
,![]() ,
,![]()
D.检验产物的简单化学方法是用湿润的石蕊试纸或浓盐酸等
15.我国国家药品监督管理局在2000年11月26日发出紧急通知,立即禁止使用含有PPA的抗感冒药,PPA是盐酸苯丙醇胺的英文符号,已知苯丙醇胺的结构简式为: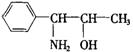 ,下列说法错误的是( )
,下列说法错误的是( )
A.它属于芳香醇类
B.它可以改变人体细胞(如肾脏)细胞膜的通透性
C.在一定条件下跟![]() 反应时,可以发生苯环上的取代反应
反应时,可以发生苯环上的取代反应
D.它具有弱碱性,可与强酸反应生成盐
16.具有单双键交替长链(如:![]() …)的高分子有可能成为导电塑料。下列是高分子中可能成为导电塑料的是( )
…)的高分子有可能成为导电塑料。下列是高分子中可能成为导电塑料的是( )
A.聚乙烯 B.聚丁二烯 C.聚苯乙烯 D.聚乙炔
第Ⅱ卷(非选择题,共56分)
二、(本题包括两小题,共20分)
17.(10分)实验室有CuO和Cu粉的混合物。请你利用给出的实验仪器及试剂,设计两种测定该样品(已称得其质量为m克)中氧化铜质量分数的方法,并填写表格中的有关内容。
| 实验 方法 | 实验过程中所发生反应的化学方程式 | 实验所用仪器(用编号表示) | 实验需直接测定的有关物理量(用文字说明) |
| 1 | |||
| 2 |
实验可能用到的主要仪器:
①托盘天平 ②启普发生器 ③硬质玻璃管 ④泥三角 ⑤烧杯
⑥坩埚 ⑦酒精灯 ⑧玻璃棒 ⑨漏斗 ⑩干燥管
a.锌粒 b.稀硫酸 c.氯化钠溶液 d.浓硫酸
18.(10分)工业上测量![]() 、
、![]() 、
、![]() 混合气体中
混合气体中![]() 含量的装置如下图。反应管中装有碘的淀粉溶液。
含量的装置如下图。反应管中装有碘的淀粉溶液。![]() 和I2发生的反应为(
和I2发生的反应为(![]() 、
、![]() 不与
不与![]() 反应):
反应):![]()
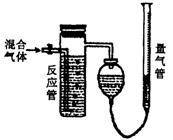
(1)混合气体进入反应管后,量气管内增加的水的体积等于________的体积(填写气体的分子式)。
(2)反应管内溶液蓝色消失后,没有及时停止通气,则测得的![]() 含量________(选填:偏高,偏低,不受影响)。
含量________(选填:偏高,偏低,不受影响)。
(3)反应管内的碘的淀粉溶液也可以用________代替(填写物质名称)。
(4)若碘溶液体积为![]() ,浓度为cmol·
,浓度为cmol·![]() 。
。![]() 与
与![]() 的体积为
的体积为![]() (已折算为标准状况下的体积)。用C、
(已折算为标准状况下的体积)。用C、![]() 、
、![]() 表示
表示![]() 的体积百分含量为:___________________________________。
的体积百分含量为:___________________________________。
(5)将上述装置改为简易实验装置,除导管外,还需选用的
仪器为________(选下列仪器的编号)。
a.烧杯 b.试管 c.广口瓶 d.容量瓶 e.量筒 f.单孔塞 g.双孔塞
三、(本题包括两小题,共18分)
19.(9分)碘缺乏症遍及全球,估计我国患者约100万人,控制该病较有效的方法是食用含碘食盐。我国政府以国家标准规定在食盐中添加碘酸钾(![]() ),据此回答:
),据此回答:
(1)碘是合成________激素的主要原料之一。
(2)长期生活在缺碘山区,又得不到碘盐供应,易患______________________。
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾,反应的化学方程式__________________________,氧化产物与还原产物的物质的量之比为________。
(4)已知![]() 可用电解法制得,其原理是:以石墨为阳极,不锈钢为阴极,在一定的电流和温度下电解KI溶液,总反应方程式为:
可用电解法制得,其原理是:以石墨为阳极,不锈钢为阴极,在一定的电流和温度下电解KI溶液,总反应方程式为:![]() ,则两极反应式分别为:阳极______________________;阴极____________________。
,则两极反应式分别为:阳极______________________;阴极____________________。
20.(9分)绿矾(化学式![]() )是硫酸法生产钛白粉的主要副产物,每生产1t钛白粉,副产绿矾4.5~5.0t,目前全国每年约副产物75万吨,除极少量用于制备新产品外,绝大部分作为废料弃去,对环境造成污染。因此开发综合利用绿矾的工艺,是一项很有意义的工作。某研究者提出如图所示的绿色工艺流程。
)是硫酸法生产钛白粉的主要副产物,每生产1t钛白粉,副产绿矾4.5~5.0t,目前全国每年约副产物75万吨,除极少量用于制备新产品外,绝大部分作为废料弃去,对环境造成污染。因此开发综合利用绿矾的工艺,是一项很有意义的工作。某研究者提出如图所示的绿色工艺流程。
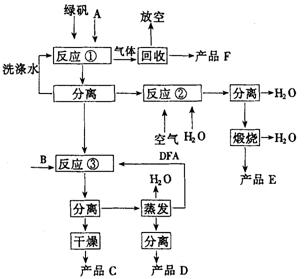
其中B是氯化物,C是不含氯的优质钾肥,D是一种氮肥,E是红色颜料;A,B,C,D均是盐类,E和F是常见的化合物。该工艺实现了原料中各主要成分的利用率均达94%以上,可望达到综合利用工业废弃物和防治环境污染的双重目的。
(1)写出A,B,C,D,E,F的化学式。
(2)写出反应①,②,③的化学方程式。
四、(本题包括两小题,共18分)
21.(9分)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应
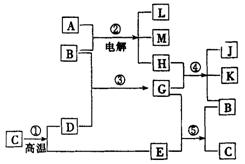
(1)单质L是________。
(2)化合物B是________。
(3)图中除反应①以外,还有两个用于工业生产的反应,是________和________(填代号)。
它们的化学反应方程式分别是____________________和___________________。
22.(9分)A是一种含碳、氢、氧三种元素的有机化合物。已知:A中碳的质量分数为44.1%,氢的质量分数为8.82%;A只含一种官能团,且每个碳原子上最多只连一个官能团;A能与乙酸发生酯化反应,但不能在两个相邻碳原子上发生消去反应。请填空:
(1)A的分子式是________,其结构简式是________。
(2)写出A与乙酸反应的化学方程式:________。
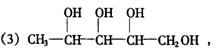
(3)写出所有满足下列3个条件的A的同分异构体的结构简式。①属直链化合物;②与A具有相同的官能团;③每个碳原子上最多只连一个官能团。这些同分异构体的结构简式是________。
参考答案
一、
1.C 尼龙是人工合成,而不是天然高分子化合物.
2.B
3.B ![]() 相当
相当![]() mol,应含
mol,应含![]() 个
个![]() ,A错误,C中1.8g重水应含中子数为
,A错误,C中1.8g重水应含中子数为![]() 个,C答案错误.标状下11.2L臭氧中含
个,C答案错误.标状下11.2L臭氧中含![]() 个氧原子.D答案错误,故正确答案为B.
个氧原子.D答案错误,故正确答案为B.
4.C C错误,正确的为![]() .
.
5.B 为酸中毒病人输液不应选酸性的试剂,![]() 溶液显酸性.
溶液显酸性.
6.A
7.B 寻找非含硫燃料的替代品或使二氧化硫的转化.
8.B 离子方程式表示强酸与可溶的可电离的亚硫酸盐反应.
9.B ![]() 与
与![]() 易形成络合物.
易形成络合物.
10.C 乙醇是一种很好的溶剂,分离苯酚和乙醇时要先把苯酚转化为盐后复原.
11.D 扑热息痛的官能团有酚羟基、肽键等,据此信息判断.
12.D 原电池原理的本质是负极失去电子,正极得到电子.
13.B 电解槽的阳极发生氧化反应,阴极发生还原反应.
14.B 甲的作用是干燥、调节气流并混合气体.
15.A 苯丙醇胺的结构中有—![]() ,—OH.
,—OH.
16.D 抓住导电塑料的特征:具有单双键交替.
二、
17.
| 实验 方法 | 实验过程中所发生反应的化学方程式 | 实验所用仪器 (用编号表示) | 实验需直接测定的有关物理量(用文字说明) |
| 1 |
| ①②③⑦ | 实验前样品和硬质玻璃管的总质量(或硬质玻璃管的质量)实验后Cu及硬质玻璃管的总质量 |
| 2 |
| ①⑤⑧⑨ | 过滤后剩余固体的质量 |
| 3 |
| ①④⑥⑦⑧ | 实验前坩埚与样品总质量(或坩埚质量) 实验后坩埚与CuO总质量 |
18.[答案](1)![]() 、
、![]() 的体积 (2)偏低 (3)酸性高锰酸钾溶液或溴水
的体积 (2)偏低 (3)酸性高锰酸钾溶液或溴水
(4)![]()
(5)bceg或beg或ceg
[解析](1)由于![]() 与
与![]() 反应,量气管内增加的水的体积就等于难溶于水的
反应,量气管内增加的水的体积就等于难溶于水的![]() 、
、![]() 的总体积.(2)通入气体总体积增加,有一部分
的总体积.(2)通入气体总体积增加,有一部分![]() 未与
未与![]() 反应,则测得
反应,则测得![]() 的含量偏低.
的含量偏低.
(3)能与![]() 完全反应且有明显的颜色变化的试剂即可.
完全反应且有明显的颜色变化的试剂即可.
(4)![]() 由反应方程式可知
由反应方程式可知![]()
![]()
![]()
(5)用量筒、双孔塞、配双孔塞的仪器即可.
三、
19.(1)甲状腺 (2)地方性甲状腺肿
(3)![]() 5∶1
5∶1
(4)![]()
![]()
20.(1)A.![]() 或
或![]() B.KCl C.
B.KCl C.![]() D.
D.![]() E.
E.![]() F.
F.![]()
(2)①![]()
![]()
②![]()
![]()
③![]()
四、
21.[答案](1)![]() (2)
(2)![]() (3)②,④
(3)②,④ ![]()
![]()
[解析]由题给信息知: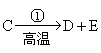 ,又是工业生产中的反应,可大致推得:C为
,又是工业生产中的反应,可大致推得:C为![]() ,反应⑤是实验室鉴定化合物E的反应,可知E为
,反应⑤是实验室鉴定化合物E的反应,可知E为![]() ,D为CaO,G为
,D为CaO,G为![]() ,B为
,B为![]() ,A、B进行电解有可能是工业制取,A可能为NaCl,反应后生成,L为
,A、B进行电解有可能是工业制取,A可能为NaCl,反应后生成,L为![]() 、M为NaOH,H为
、M为NaOH,H为![]() ,H与G即
,H与G即![]() 与
与![]() 反应,生成B为
反应,生成B为![]() 、
、![]() 、
、![]() ,因此反应④为工业上制漂白粉的反应.
,因此反应④为工业上制漂白粉的反应.
22.[答案](1)![]()
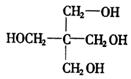
(2)![]()
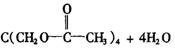
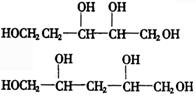
[解析]A中氧的质量分数为100%-44.1%-8.82%=47.08%
![]()
又∵两个相邻碳原子上不能发生消去反应,碳骨架为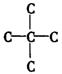 ,与乙酸发生酯化反应,所以含—OH.可以将最简式扩大5倍得分子式为
,与乙酸发生酯化反应,所以含—OH.可以将最简式扩大5倍得分子式为![]() ,正好满足价键规律.结构简式为:
,正好满足价键规律.结构简式为: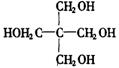 ,其它可以作答.
,其它可以作答.