高三化学中常见的置换反应类型归纳
置换反应类型在解答无机框图推断试题过程中具有其特殊的功用,以其特殊的形式往往成为解题的突破口。但由于学生在学习过程中,不善于积累,缺乏总结,置换反应的实例在头脑中没贮存多少,因而对这类试题总是感到束手无策。现将置换反应的实例类型归纳如下。
一、按元素的性质划分,金属与非金属单质间的置换。
1、金属置单质换金属单质
2Al+Fe2O3 ![]() Al2O3+2Fe
Al2O3+2Fe
(铝热反应。Al还可与V2O5、CrO3、WO3、MnO2等发生置换) Fe+CuSO4 ![]() FeSO4+Cu
FeSO4+Cu
2、金属单质置换非金属单质
2Na+2H2O ![]() 2NaOH+H2
2Mg+CO2
2NaOH+H2
2Mg+CO2 ![]() 2MgO+C
3Fe+4H2O(g)
2MgO+C
3Fe+4H2O(g)![]() Fe3O4+4H2
Fe3O4+4H2
3、非金属单质置换金属单质
H2+CuO![]() Cu+H2O C+FeO
Cu+H2O C+FeO![]() Fe+CO Si+2FeO
Fe+CO Si+2FeO![]() 2Fe+SiO2
2Fe+SiO2
4、非金属单质置换非金属单质
2F2+2H2O![]() 4HF+O2 2C+SiO2
4HF+O2 2C+SiO2 ![]() Si+2CO
Si+2CO
C+H2O ![]() CO+H2
2H2+SiCl4
CO+H2
2H2+SiCl4 ![]() Si+4HCl
Si+4HCl
二、按元素在周期表的位置划分,同族元素单质间的置换与不同族元素单质间的置换。
1、同主族元素单质间的置换
Na+KCl![]() NaCl+K 2Na+2H2O
NaCl+K 2Na+2H2O![]() 2NaOH+H2
2NaOH+H2
2H2S+O2 ![]() 2S+2H2O
2C+SiO2
2S+2H2O
2C+SiO2![]() Si+2CO
Si+2CO
Cl2+2HI![]() 2HCl+I2
F2+2HCl
2HCl+I2
F2+2HCl![]() 2HF+Cl2
2HF+Cl2
2、不同主族元素单质间的置换
Mg+2HCl![]() MgCl2+H2 2Mg+CO2
MgCl2+H2 2Mg+CO2![]() 2MgO+C
2MgO+C
2Al+6HCl![]() 2AlCl3+3H2 2F2+2H2O
2AlCl3+3H2 2F2+2H2O![]() 4HF+O2
4HF+O2
C+H2O![]() CO+H2
2H2+SiCl4
CO+H2
2H2+SiCl4![]() Si+4HCl
Si+4HCl
H2S+Cl2 ![]() S+2HCl
3Cl2+8NH3
S+2HCl
3Cl2+8NH3![]() 6NH4Cl+N2 4NH3+3O2
6NH4Cl+N2 4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
3、主族元素单质置换副族元素的单质
H2+CuO![]() Cu+H2O 2Al+Fe2O3
Cu+H2O 2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
C+CuO![]() Cu+CO
2Al+3Hg2+
Cu+CO
2Al+3Hg2+ ![]() 2Al3++3Hg Na+TiCl4
2Al3++3Hg Na+TiCl4 ![]() 4NaCl+Ti
4NaCl+Ti
4、副族元素的单质置换主族元素单质
3Fe+4H2O(g)![]() Fe3O4+4H2
Zn+2H+
Fe3O4+4H2
Zn+2H+ ![]() Zn2++H2
Zn2++H2
5、副族元素的单质置换副族元素的单质
Fe+CuSO4 ![]() FeSO4+Cu
FeSO4+Cu
三、按物质类别划分,单质与氧化物间的置换和单质与非氧化物间的置换。
1、单质与氧化物发生置换反应
2Na+2H2O![]() 2NaOH+H2
2Mg+CO2
2NaOH+H2
2Mg+CO2 ![]() 2MgO+C
2MgO+C
3Fe+4H2O(g)![]() Fe3O4+4H2
H2+CuO
Fe3O4+4H2
H2+CuO![]() Cu+H2O
Cu+H2O
C+FeO![]() Fe+CO
2F2+2H2O
Fe+CO
2F2+2H2O![]() 4HF+O2
4HF+O2
2C+SiO2![]() Si+2CO
2Al+Fe2O3
Si+2CO
2Al+Fe2O3![]() Al2O3+2Fe
Al2O3+2Fe
C+H2O![]() CO+H2
2H2+SiCl4
CO+H2
2H2+SiCl4![]() Si+4HCl
Si+4HCl
Si+2FeO![]() 2Fe+SiO2
3H2+Fe2O3
2Fe+SiO2
3H2+Fe2O3![]() 2Fe+3H2O
2Fe+3H2O
2、单质与非氧化物发生置换反应
2H2+SiCl4![]() Si+4HCl
H2S+Cl2
Si+4HCl
H2S+Cl2![]() S+2HCl
S+2HCl
3Cl2+8NH3![]() 6NH4Cl+N2
4NH3+3O2
6NH4Cl+N2
4NH3+3O2![]() 2N2+6H2O
2N2+6H2O
Mg+2HCl![]() MgCl2+H2
2Al+6HCl
MgCl2+H2
2Al+6HCl![]() 2AlCl3+3H2
2AlCl3+3H2
四、应用举例
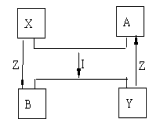
[题目]X、Y、Z是短周期元素的单质,A、B是它们的化合物物质之间的转化关系如图(其中反应条件和某些生成物已略去)(1)如果X、Y的组成元素是同主族时,按下列要求写出反应的化学方程式:
① 已知A、B是水
② 已知A、B都是氧化物
(2)如果X、Y的组成元素不是同一主族时,按下列要求写出X、Y、Z的化学式:
①若X的组成元素是地壳中含量最多的金属元素,则X Z
②若Y的成元素在自然界中形成的化合物种类最多,则X
Z
[分析](1)此题的关键是抓住"A+X![]() B+Y"这个置换反应来分析。因X、Y是同主族元素单质间的置换,若A、B又都是水,根据上述第二种分类中的第一条可知,那①的反应唯一只能是2H2S+O2
B+Y"这个置换反应来分析。因X、Y是同主族元素单质间的置换,若A、B又都是水,根据上述第二种分类中的第一条可知,那①的反应唯一只能是2H2S+O2![]() 2S+2H2O
;根据上述第三种分类中的第二条和第二种分类中的第一条可知,若A、B 都是氧化物,那② 的反应只能是 2C+SiO2
2S+2H2O
;根据上述第三种分类中的第二条和第二种分类中的第一条可知,若A、B 都是氧化物,那② 的反应只能是 2C+SiO2![]() Si+2CO
;
Si+2CO
;
(2)根据上述第二种分类中的第二条可知,X、Y为不同的主族,又根据①②的限制条件,得出①②两问的答案分别为:
① X Al Z Cl2
② X Mg Z O2