高三化学秋学期第一次质量抽测
试卷 命题人:马罗平
本卷可能用到的原子量 H:1 C:12 N:14 S:32 K:39 Ca:40 O:16 Na:23
一、选择题:(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1、水的状态除了气、液和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形态,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是: ( )
(A)水由液态变为玻璃态,体积缩小 (B)水由液态变为玻璃态,体积膨胀
(C)玻璃态是水的一种特殊状态 (D)玻璃态水是分子晶体
2、金属的下列性质中,与自由电子无关的是: ( )
(A)密度大小 (B)容易导电 (C)延展性好 (D)易导热
3、用饱和的氯化铁溶液制取氢氧化铁胶体,正确的操作是: ( )
(A)将FeCl3溶液滴入蒸馏水即可
(B)将FeCl3溶液滴入热水中,得到黄色液体即可
(C)将FeCl3溶液滴入沸水中,得到红褐色溶液即可
(D)将FeCl3溶液滴入沸水中,并继续加热煮沸至生成红褐色沉淀即可
4、今有下列三个氧化还原反应:
① 2FeCl3+2KI === 2FeCl2 + 2KCl + I2
② 2FeCl2+Cl2 === 2FeCl3
③ 2KMnO4 + 16HCl === 2KCl +2MnCl2 + 8H2O +5Cl2 ↑
若某溶液中有Fe2+和I-共存,要氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是:
(A)Cl2 (B)KMnO4 (C)FeCl3 (D)HCl
5、在相同条件下,燃烧时对大气污染程度最小的燃料是: ( )
(A)液化气 (B)煤油 (C)煤饼 (D)木炭
6、2H2(g) + O2(g) = 2H2O(I); ΔH = -483.6 kJ/mol
现有0.2mol炭粉和H2组成气固混合物在O2中完全燃烧共放出63.53kJ热量,则混合物中炭粉和H2的物质的量之比是:( )
(A) 1∶2 (B)2∶3 (C)3∶2 (D)1∶1
![]() 7、强酸与强碱的稀溶液发生中和反应的热效应:H+(aq) + OH-
(aq) = H2O(l);ΔH = -57.3 kJ/mol,向1 L0.5mol L-1的NaOH溶液中加入下列物质:①稀醋酸 ②浓H2SO4 ③稀硝酸恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是: ( )
7、强酸与强碱的稀溶液发生中和反应的热效应:H+(aq) + OH-
(aq) = H2O(l);ΔH = -57.3 kJ/mol,向1 L0.5mol L-1的NaOH溶液中加入下列物质:①稀醋酸 ②浓H2SO4 ③稀硝酸恰好完全反应时的热效应ΔH1、ΔH2、ΔH3的关系正确的是: ( )
(A)ΔH1>ΔH2>ΔH3 (B)ΔH1<ΔH3<ΔH2
(C)ΔH2>ΔH1>ΔH3 (D)ΔH1>ΔH3>ΔH2
8、化工厂址选择是一个复杂的问题,涉及原料、水源、能源、土地供应、市场需求、交通运输和环境保护等诸多因素的制约。硫酸厂应建在: ( )
①靠近原料产地远离消费中心; ②靠近消费中心,稍偏离原料产地;
③交通便利,人口稠密的居民区 ④建在环保要求高的地区,便于“三废”的治理
(A)①②③④ (B) ①③④ (C)①②④ (D) 只有①
二、选择题(9—16小题每小题4分;17、18两小题每小题5分,共42分。每小题有一个或两个选项符合题意。)
9、用特殊方法把固体物质加工到纳米级(1nm~100nm)的超细粉末粒子,然后得到纳米材料。下列分散中分散系的微粒直径和这种粒子具有相同数量级的是: ( )
(A) 溶液 (B) 悬蚀液 (C) 胶体 (D) 乳浊液
10、下面有关晶体的叙术中,不正确的是: ( )
(A)金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
(B)氯化钠晶体中,每个Na+周围距离相等的Na+共有6个
(C)氯化铯晶体中,每个Cs+周围紧邻8个Cl-
(D)干冰晶体中,每个CO2分子周围紧邻10个CO2分子
11、现有甲、乙、丙、丁和Fe(OH)3等五种胶体,按甲和丙、乙和丁、丙和丁、乙和Fe(OH)3胶体两两混合,均出现胶体聚沉现象。则粒子带负电荷的胶体是: ( )
(A)甲和乙 (B)丙和乙 (C)甲和丁 (D)丙和Fe(OH)3胶体
12、人体正常血红蛋白中含有Fe2+,若误食亚硝酸盐,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。对上述事实的分析正确的是:( )
(A)亚硝酸盐是还原剂 (B)维生素C是氧化剂
(C)维生素C将Fe3+还原成Fe2+ (D)亚硝酸盐被氧化
13、下列反应中,有两个可用同一个离子方程式表示,它们是:( )
①CO2通入CaCl2溶液 ②碳酸钾溶液与氯化钙溶液混合
③Ca(HCO3)2溶液中滴入少量NaOH溶液 ④石灰水中滴入少量NaHCO3溶液 ⑤碳酸钠溶液中滴入硝酸钙溶液
(A)①② (B)③④ (C)④⑤ (D)②⑤
14、下列离子方程式中不正确是的:( )
(A)过量NaOH溶液与碳酸氢钙溶液: Ca2+ + HCO- 3 + OH- = CaCO3↓+ H2O
(B)氢氟酸与氢氧化钙溶液: 2HF + Ca2+ +2OH- = 2H2O + CaF2 ↓
(C)向KOH溶液中通入过量SO2: SO2 + 2OH-= SO2- 3 + H2O
(D) 向NaAlO2溶液中滴加AlCl3溶液: Al3+ + 3AlO- 2 + 6H2O = 4Al(OH)3↓
15、用铁酸钠(Na2FeO4)对未来河湖的淡水消毒是城市饮水处理新技术,下列对铁酸钠用于饮水处理的分析正确的是:( )
(A)Na2FeO4在溶液中显酸性,能消毒杀菌
(B)在Na2FeO4中铁元素显+6价,具有强氧化性胶体,使水中悬浮物聚沉
(C)Na2FeO4的还原产物Fe3+易水解产生Fe(OH)3胶体,使水中悬浮物聚沉
(D)Na2FeO4还原产物Fe2+水解得Fe(OH)2胶体,使悬浮物聚沉
16、将可溶性淀粉于热水制成淀粉溶液,该溶液可能不具有的性质是: ( )
(A)电泳 (B)布朗运动 (C) 聚沉 (D)丁达尔效应
17、下列各组离子,在所给条件下能够大量共存的是: ( )
(A)pH = 0 的溶液中,Fe3+、Mg2+、Cl-、SO2-4
![]() (B)水电离出的c(H+) = 1×10-1 mol L-1的溶液中,K+、HCO3-、Cl-、S2-
(B)水电离出的c(H+) = 1×10-1 mol L-1的溶液中,K+、HCO3-、Cl-、S2-
(C)使pH试纸显深蓝色的溶液中,Cu2+、Fe3+、NO3-、SO2-4
(D)在AlCl3溶液中Na+、AlO- 2、SO2-4、NO3-
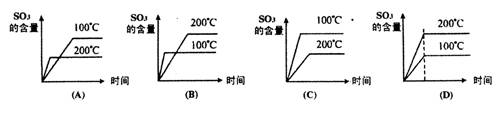 |
18、在接触法生产硫酸中,对于SO2的接触氧化反应有下面4个图,其中正确的是:
( )
三、实验题(共20分)
19、(8分)在实验室利用胆矾晶体和烧碱溶液,经下列步骤制备氧化铜固体:
①溶解胆矾; ②滴加烧碱溶液; ③过滤 ④灼烧滤渣。试填空:
(1)在实验中多次用到玻璃棒,其作用有三个,分别是__________,____________,______________。
(2)氢氧化铜微热即分解,其化学反应方程式是:_______________________。
(3)乙同学改进了上述实验步骤,即把“先过滤后灼烧”改为“先加热浑浊液后过滤”。因为甲同学的后两步操作的缺点是______________________________________。
![]()
![]() 20、(12分)某同学每次量取50mL0.55mol L-1NaOH溶液和50mL0.50mol L-1HCl溶液混合反应,做“中和热的测定”实验,回答下列问题:
20、(12分)某同学每次量取50mL0.55mol L-1NaOH溶液和50mL0.50mol L-1HCl溶液混合反应,做“中和热的测定”实验,回答下列问题:
(1)实验所需的玻璃仪器有:①500mL烧杯一只;②100mL小烧杯一只;
③____________; ④____________;⑤环形玻璃搅拌棒。
![]()
![]() (2)为什么选用0.55mol L-1的NaOH溶液而不是0.50mol L-1NaOH溶液?
(2)为什么选用0.55mol L-1的NaOH溶液而不是0.50mol L-1NaOH溶液?
____________________________________________________________________
(3)在实验过程中,将NaOH溶液一次倒入盛有稀盐酸的小烧杯中,盖上塑料盖板后接下来的操作是___________________________________________________。再重复一次实验。
(4)设计数据记录和数据处理的表格(不必填数据),取测量所得数据的平均值作为计算依据。
![]()
![]() (5)已知中和反应后生成的稀溶液的比热容C=4.18J/(g ℃),且反应前后溶液的密度均为1.00g cm-3,若两次实验中测得反应前后溶液的平均温度差为3.35℃,则此实验测得的“中和热”=_____________(保留三位有效数字)
(5)已知中和反应后生成的稀溶液的比热容C=4.18J/(g ℃),且反应前后溶液的密度均为1.00g cm-3,若两次实验中测得反应前后溶液的平均温度差为3.35℃,则此实验测得的“中和热”=_____________(保留三位有效数字)
(6)请将上述测定值与△H=-57.3kJ·mol-1比较,可能导致这一误差的原因是______。
A、量取碱溶液时,仰视读数
B、没有使用玻璃棒搅拌
C、由于当时室温较低,某学生进入实验后,就打开空调制热,实验过程中室温一直缓慢升高
D、该学生不慎错用同浓度的醋酸当作盐酸做实验
(7)根据(6)中的数据,写出此实验的热化学方程式(离子)。
_________________________________________________________________。
四、填空题:(共38分)
21、(8’)(1)配平以下离子反应方程式
□MnO- 4 + □Fe2+ + □H+ — □Mn2+ + □Fe3+ + □H2O
反应中,______________是氧化产物。
(2)有两种钠盐分别溶于水后,溶液的pH均大于7,且均能使酸性品红溶液褪色;写出此两种钠盐溶液呈碱性的离子方程式______________________、_________________。
![]()
![]() 22、(6’)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:_______________。若1g水蒸气转化成液态水放热2.444
kJ,则反应H2(g)+ O2(g) = H2O(1)的△H=______________ kJ mol-1。氢气的燃烧热为______________。
22、(6’)由氢气和氧气反应生成1mol水蒸气放热241.8kJ,写出该反应的热化学方程式:_______________。若1g水蒸气转化成液态水放热2.444
kJ,则反应H2(g)+ O2(g) = H2O(1)的△H=______________ kJ mol-1。氢气的燃烧热为______________。
23、(14’)形成酸雨的原理之一可简示如下:
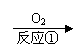 |
| |||||
| ||||||
![]()
![]() 含硫燃料
A
B
硫酸。回答下列问题:
含硫燃料
A
B
硫酸。回答下列问题:
(1)A物质的化学式________,B物质的化学式___________。
(2)三个反应中不属于氧化还原反应的是_____________(填序号)
(3)SO2中硫元素显+4价,它可能降低到0价,利用这一性质可在工厂烟道气中通入合适的____________(填“氧化剂”或“还原剂”)除去SO2,达到减小污染的目的。
(4)从环境保护的角度认为:雨水的pH<5.6时,就判断为酸雨,已知pH= -lgc(H+),经测定某次雨水只含硫酸,且浓度为5×10-5mol/L,这次降雨__________(填“是”或“不是”)酸雨。
(5)火力发电厂燃烧的煤中含有大量的硫,其排出的废气中往往含有SO2、O2、N2、CO2等。为了除去有害的SO2气体,在英国已进行的一个研究结果表明:高烟囱可以有效降低地表面SO2浓度。在20世纪60年代到70年代的10年间,由发电厂排放的SO2增加了35%。但由于建造高烟囱的结果,地面浓度降低了30%之多。
(Ⅰ)你认为减少酸雨产生的途径可采取的措施是____________
(A)少用煤作燃料 (B)把工厂烟囱造高
(C)燃料脱硫 (D)把工厂迁移到农村 (E)开发新能源
(Ⅱ)请从全球环境保护角度,分析这种建造高烟囱的方法是否可取________,理由是___________________________________________________________________。
24、(10’)含CN- 的废水危害很大。处理该废水时,可在催化剂TiO2作用下用NaClO将CN-(C为+2价)氧化成CNO-(C为+4价)。CNO-在酸性条件下继续被NaClO氧化生成N2与CO2。某环保部门用下图装置进行实验,以证明该处理方法的有效性并测定CN-被处理的百分率。
![]()
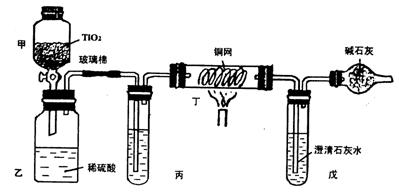 |
将浓缩后含CN-的废水与过量NaClO溶液的混合液(其中CN-浓度为0.05mol L-1)200mL倒入甲中,塞上橡皮塞,一段时间后,打开活塞。使溶液全部放入乙中,关闭活塞。
(1)甲中反应的离子方程式为_________________________________。
乙中反应的离子方程式为_________________________________。
(2)乙中生成的气体除CO2,N2外还有HCl及副反应生成的Cl2等,上述实验是通过测定CO2的量来确定CN-处理效果。
①丙中加入的除杂质试剂是___________(填标号)。
(A)饱和食盐水 (B)饱和NaHCO3溶液
(C)浓NaOH溶液 (D)浓硫酸
②丁在实验中的作用是______________________________________________
③戊中盛有足量的石灰水,若实验后戊中共生成0.8g沉淀,则该实验中CN-被处理的百分率____________80%(填“>”、“=”、“<”)。
五(本题包括2小题,共18分)
25、(6’)为测定wgKNO3样品的纯度(杂质不溶于水),放入一定量的水中充分搅拌,测得如下数据:
| 温度(℃) | 10 | 40 | 75 |
| 剩余固体质量(g) | 18.9 | 10.3 | 1 |
| 溶解度(g/100gH2O) | 20.9 | 63.9 | 150 |
求:(1)一定量的水的质量;(2)样品的质量(w);(3)样品的纯度。
(计算结果保留3位有效数字)
![]() 26、(12’)400mL0.500mol L-1的NaOH溶液中通入一定量的SO2气体,然后在低温下蒸发溶液,得到白色固体A。
26、(12’)400mL0.500mol L-1的NaOH溶液中通入一定量的SO2气体,然后在低温下蒸发溶液,得到白色固体A。
(1)推测此白色固体A所有可能的组成,将其化学式填入下表。
| 编 号 | ① | ② | ③ | ④ |
| 组成A的物质 的化学式 |
(2)若A的质量为16.7g,通过计算确定A的物质组成及其质量。
秋学期第一次质量抽测
高三化学答案卷 命题人:马罗平
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 选项 | ||||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 选项 |
三、实验题(共20分)
19、(8分)
(1)__________,____________,______________。
(2)_________________________________________________________。
(3)_________________________________________________________。
![]() 20、(12分)
20、(12分)
(1)③____________; ④____________;
(2)_________________________________________________________
(3)__________________________________________________________。
(4)
(5)_____________(保留三位有效数字) (6)______________
(7)_____________________________________________________。
四、填空题:(共38分)
| |
| |
| |
| |
| |
| |
反应中,______________是氧化产物。
(2)__________________________、___________________________。
22、(6’) ____________________。______________ ,______________。
23、(14’)(1)A ________,B ___________。(2)__________(填序号)
(3)___________(4)__________
(5)(Ⅰ)____________
(Ⅱ)________, __________________________________________。
24、(1) 甲_________________________________。
乙_________________________________。
(2)①__________ ②__________________________________________
③____________
五(本题包括2小题,共18分)
25、(6’)
![]() 26、(12’)(1)
26、(12’)(1)
| 编 号 | ① | ② | ③ | ④ |
| 组成A的物质 的化学式 |
(2)