上期中考
高三化学试题
命题人:张启军
说明:1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)满分110分,考试时间60分钟。
2.将第Ⅰ卷和第Ⅱ卷的答案答在答案卷的相应位置上.
3.可能用到的原子量:H = 1 C = 12 N = 14 O = 16 Na = 23 Cl = 35.5
第Ⅰ卷(选择题,共48分)
一、 选择题: 本题共8小题,每小题6分,共48分。每小题只有一个正确答案。
1、以NA表示阿伏加德罗常数,下列说法中正确的是:
A.在常温常压下,11.2 L 氮气所含原子数为 NA
B.常温常压下,1 mol甲基(-CH3)所含电子数为 10 NA
C.500 mL 0.5 mol·L―1的CaCl2溶液中,含有Cl - 的数目为 0.25 NA
D.92 g NO2 和92 g N2O4 所含有原子数均为 6 NA
2、等物质的量的N2、O2、CO2 混合气体通过 Na2O2 后,体积变为原来的8 / 9(同温同压), 这时混合气体中 N2、O2、CO2 物质的量之比为:
A. 3∶4∶1 B. 3∶3∶2 C. 6∶7∶3 D.6∶9∶0
3、下列各组物质中,不能按![]() (“→”表示一步完成)关系相互转化的是:
(“→”表示一步完成)关系相互转化的是:
| 选 项 | A. | B. | C. | D. |
| a | HNO3 | S | C | FeCl2 |
| b | NO | H2S | CO | Fe (OH)2 |
| c | NO2 | SO2 | CO2 | Fe (OH)3 |
4、下列各组物质中,仅用水及物质间相互反应不能一 一区别的一组是:
A.Na2O2 Al2(SO4)3 MgCl2 K2CO3
B.BaCl2 Na2SO4 (NH4)2SO4 KOH
C.AgNO3 NaCl KCl CuCl2
D.Fe2(SO4)3 K2CO3 KHSO4 NH4Cl
5、下列离子方程式书写正确的是:
A.在氢氧化钡溶液中加入少量的硫酸氢钠溶液:
Ba2+ + 2 OH─+ 2 H + + SO42─ = BaSO4↓ + 2 H2O
B.向次氯酸钙溶液中通入二氧化硫:
Ca2+ + 2 ClO─ + SO2 + H2O = CaSO3↓+ 2 HClO
C.小苏打溶液与甲酸混合:
HCO3─ + HCOOH = HCOO─+ CO2↑ + H2O
D.碳酸氢钙溶液跟稀硝酸反应:
Ca(HCO3)2 + 2 H + = Ca2+ + 2 CO2↑ + 2 H2O
6、由于碘是卤素中原子半径较大的元素,可能呈现金属性。下列事实最能够说明这个结论的是:
A.已经制得了 IBr、ICl 等卤素互化物
B.已经制得 I2O5 等碘的氧化物
C.已经制得了I (NO3)3、I (ClO4)3·2H2O等含 I3+ 离子化合物
D.碘(I2)易溶于KI等碘化物溶液,形成I3- 离子
7、下列关于浓硫酸的叙述正确的是:
A.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
B.浓硫酸具有吸水性,因而能使蔗糖炭化
C.浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
D.浓硫酸在常温下能够使铁、铝等金属钝化
8、下列有关碳族元素的说法错误的是:
①原子最外层电子数是4 ②碳与强氧化剂氯气反应时失去4个电子生成离子化合物四氯化碳 ③石墨在一定条件下转化变成金刚石是化学变化 ④铅的熔点比锗高,锡的沸点比铅低 ⑤单质都是无色晶体 ⑥从C → Pb,其最高价氧化物的水化物酸性渐强 ⑦除Pb之外,其他元素的+4价化合物是稳定的 ⑧稳定性SiH4 ﹤ CH4﹤ H2O﹤ HF ⑨硅的非金属性比金属性强,而锗的金属性比非金属性强
A. 全错
B.①③⑦⑧⑨
C.②④⑤⑥
D.以上答案均不合题意
第Ⅱ卷(非选择题,共62分)
二、 填空题:本题共4题,共62分。
9、(1)(4分)要配制浓度约为2 mol·L─1 NaOH溶液100 mL,下面的操作正确的是 (填代号)。
A. 称取8 g NaOH 固体,放入250 mL 烧杯中,用100 mL 量筒量取100 mL 蒸馏水,加入烧杯中,同时不断搅拌至固体溶解
B. 称取8 g NaOH 固体,放入100 mL 量筒中,边搅拌,边慢慢加入蒸馏水,待固体完全溶解后用蒸馏水稀释至100 mL
C. 称取8 g NaOH 固体,放入100 mL容量瓶中,加入适量蒸馏水,振荡容量瓶使固体溶解,再加入水到刻度,盖好瓶塞,反复摇匀
D. 用100 mL量筒量取40 mL 5 mol·L─1 NaOH溶液,倒入250 mL 烧杯中,再用同一量筒取60 mL蒸馏水,不断搅拌下,慢慢倒入烧杯中
(2)(22分)
①指出在使用下列仪器(已净)或用品的第一步操作:
| 石蕊试纸检验气体 | 容量瓶 |
②下面是中学化学实验常见的几种定量仪器:
A.量筒 B.容量瓶 C.滴定管 D.托盘天平,其中(填代号)
| 标出仪器使用温度的是 | 标有0刻度,且0刻度在上方的是 | 能够用以精确量取液体体积的是 | 使用A、C时由于俯视读数,使得到的数据比正确数据偏小的是 |
③配制一定物质的量浓度为0.2 mol/L NaOH溶液 500 mL,填空并请回答下列问题:
| 应称量NaOH的质量 | 应选用容量瓶的规格 | 除容量瓶外还需要的其它仪器 |
| g | mL |
|
Ⅰ)用托盘天平称取固体样品(含烧杯)时(1 g 以下使用游码),若将样品放在了天平的右盘,读数为10.5g,则所称样品(含烧杯)的实际质量为 g。
Ⅱ)下列操作对配制的NaOH溶液浓度有偏高影响的是 。
A.称量时将NaOH固体直接放在天平托盘上面的纸上
B.将称量的NaOH固体露置在空气的时间过长
C.选用的容量瓶内有少量的蒸馏水
D.在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
E.定容时,俯视观察液面与容量瓶刻度线之间的关系
10、(14分)短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请回答:
(1)X元素的名称是 ;Y元素的名称是 ;
Z元素的名称是 。
(2)XZ3 化合物的分子式是 ,电子式是 。
(3)写出Y的含氧酸的分子式 。
(4)写出X的最高价含氧酸与澄清石灰水反应的离子方程式 。
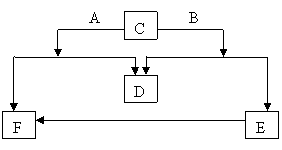
11、(12分) 已知D是单质,其它均是常见的化合物,它们的转化关系如图所示,摩尔质量MA ﹤ MB ,则 A、B、C、D、E、F的化学式是:
A , B , C ,D ,E ,F
12、(10分)据2004年1月17日报道,意大利科学家使用普通氧分子和带正电的氧化离子作用,制出了新型的氧分子O4,它的结构很复杂,可能具有与S4相似的长方形结构。
(1)下列有关O4的说法正确的是:
A.O4分子内存在极性共价键
B.合成O4的反应可看作核聚变反应,即不属于化学变化
C.O4与O3、O2都是氧的同素异形体
D.O4将来可用作更强有力的火箭推进的氧化剂
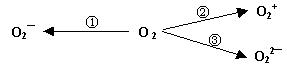 (2)制备含O2─、O22─ 甚至O2+ 的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
(2)制备含O2─、O22─ 甚至O2+ 的化合物都是可能的,通常它们是在氧分子进行下列各种反应时生成的:
上述反应中, (填序号)相当于氧分子被氧化; (填序号)相当于氧分子被还原。
(3)写出O22─ 的电子式:
(4)O2[PtF6]是一种含有O2+ 的化合物,请写出一种含有O2─ 的化合物的化学式: