高三化学同步测试(1)
一、选择题(共8小题,每小题4分,每小题只有一个答案符合题意)
1.下列化工生产过程中所发生的主要化学反应不属于氧化还原反应的是
A.用氯气和消石灰制漂白粉 B.铝热法冶炼金属钒
C.用油脂制肥皂 D.电解饱和食盐水制烧碱
2.下列热化学方程式中△H的绝对值能表示可燃物的燃烧热的是
A.H2(g)+Cl2(g)=2HCl(g);△H=-184.6kJ/mol
B.CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-802.3kJ/mol
C.2H2(g)+O2(g)=2H2O(l);△H=-571.6kJ/mol
D.CO(g)+1/2O2(g)=CO2(g);△H=-283kJ/mol
3.限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应符合离子方程式2H++SO32-=H2O+SO2的化学方程式个数有
A.4 B.5 C.8 D.12
4.下列物质的名称分别是
| 名称 | 硫代硫酸钠 | 多硫化钙 | 过氧化钡 | 超氧化钾 |
| 化学式 | Na2S2O3 | CaSx | BaO2 | KO2 |
试综合上述命名规律,分析思考后回答K2CS3的名称是
A.多硫碳酸钾 B.三硫代碳酸钾
C.过硫碳酸钾 D.超硫碳酸钾
5.在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有 A.滴加石蕊试液显红色的溶液
Fe3+ 、NH![]() 、Cl- 、SCN-
、Cl- 、SCN-
B.pH值为1的溶液
Cu2+、Na+ 、Mg2+、NO![]()
C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO![]() 、Br-、Ba2+
、Br-、Ba2+
D.所含溶质为Na2SO4的溶液 K+ 、CO![]() 、NO
、NO![]() 、Al3+
、Al3+
6.我国发射的“神舟五号”载人飞船的燃料是铝粉与高氯酸铵的混合物。点燃时,铝粉氧化放热引发高氯酸铵反应2NH4ClO4=N2↑+4H2O+Cl2↑+O2↑;△H<0。关于该反应叙述不正确的是
A.该反应属于分解反应、氧化还原反应、放热反应
B.该反应瞬间能产生大量高温气体,推动飞船飞行
C.从能量变化上看,该反应是化学能转变为热能和动能
D.反应中NH4ClO4只起到氧化剂的作用
7.在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4 中7.5mol CuSO4可氧化的P原子的物质的量为
A.1.5mol B.5.5mol C.3mol D.2.5mol
8.下列离子反应方程式书写正确的是
A.在Ba(OH)2溶液中加入少量的硫酸氢钠溶液Ba2++2OH-+2H++SO![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
B.向次氯酸钙溶液中通入SO2气体Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO
C.标准状况下,将112mLCl2缓慢注入10mL 1mol·L-1的FeBr2溶液中2Fe2++4Br-+3Cl2
|
D.向苯酚钠溶液中通入少气体
+HCO![]()
二、选择题(共10小题,每小题4分,每小题有1—2个答案符合题意)
9.根据下列反应判断有关物质的还原性由强到弱的顺序正确的是
①H2SO3+I2+H2O 2HI+H2SO4
②2FeCl3+2HI 2FeCl2+2HCl+I2
③3FeCl2+4HNO3 2FeCl3+NO↑+2H2O+Fe(NO3)3
A.H2SO3>I->Fe2+>NO B.I-> H2SO3> Fe2+>NO
C.Fe2+> I-> H2SO3>NO D.NO> Fe2+> H2SO3> I-
10.下列各组离子在碱性溶液中能大量共存,且无色透明,加酸酸化后溶液变色,但无沉淀、无气体生成的是
A.Fe2+、I-、ClO-、SO![]() B.Br-、K+、SO
B.Br-、K+、SO![]() 、BrO
、BrO![]()
C.S2-、SO![]() 、K+、SO
、K+、SO![]() D.Ca2+、Cl-、H2PO
D.Ca2+、Cl-、H2PO![]() 、Na+
、Na+
11.据报道,近日某地一辆满载砒霜的大货车翻下山坡,滑下河道,导致部分分砒霜散落到河水中,砒霜的主要成分是As2O3,剧毒,可用于制造杀虫剂和灭鼠剂等。As2O3 是两性偏酸性性氧化物,其晶体在193℃升华,微溶于水,并生成H3AsO3。 根据媒体的相关报道及所给信息判断下列说法中正确的是
A.砒霜为白色粉末状固体
B.As2O3 是砷酸(H3AsO4 )的酸酐
C.As2O3 的晶体为原子晶体
D.事矿发生后采取的应急措施是向受到砒霜污染的河水中撒入生石灰
12.在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是 A.Mg B. Cu C. Ag D. H2
13.还原2.4×![]() 到X元素的低价态时,需消耗30mL0.2mol·
到X元素的低价态时,需消耗30mL0.2mol·![]() 的亚硫酸钠溶液,则在此反应中X元素的低价态为
的亚硫酸钠溶液,则在此反应中X元素的低价态为
A.0价 B.+1价 C.-1价 D.-2价
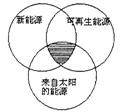
14.“能源分类相关图”如下图所示,四组能源选项中全部符合图中阴影部分的能源是
|
B.水能、生物能、天然气
C.太阳能、风能、沼气
D.地热能、海洋能、核能
15.下列离子方程式中不正确的是
A.在氯化铝溶液中加入过量烧碱溶液:Al3++4OH-=AlO2-+2H2O
B.在硫酸铜溶液中加入过量氢氧化钡溶液:Ba2++SO42-=BaSO4↓
C.在澄清石灰水中通入过量二氧化碳:CO2+OH-=HCO3-
D.在碳酸氢钙溶液中加入过量苛性钾溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
16.某溶液中含有NO![]() 、SiO
、SiO![]() 、Al O
、Al O![]() 、S2-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中大量减少的阴离子是
、S2-等四种阴离子,若向其中加入过量的盐酸溶液,微热并搅拌,再加入过量的NaOH溶液,则溶液中大量减少的阴离子是
A.NO![]() B.SiO
B.SiO![]() C.AlO
C.AlO![]() D.S2-
D.S2-
17.ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将逐渐取代Cl2成为生产自来水的消毒剂,工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A.1∶1 B.2∶1 C.1∶2 D.2∶3
18.能正确表示下列化学反应的离子方程式是
A.用碳酸钠溶液吸收少量二氧化硫:![]()
![]()
![]()
B.金属铝溶于盐酸中:![]()
![]()
![]()
C.硫化钠溶于水中:![]()
![]()
![]()
D.碳酸镁溶于硝酸中:![]()
![]()
![]()
三、填空题
19.(10分)某中学化学小组查阅资料发现金属氧化物A也能催化氯酸钾的分解,且A和MnO2 的 最佳催化温度均为500℃左右,于是对A和二氧化锰的催化性质进行了定量对照实验,实验时均以收集满500ml氧化为准(共他可能影响实验的因素均已忽略)
表一用MnO2作催化剂
| 实 验 序 号 | KclO3 适量(g) | MnO2 适量(g) | 反应温度 (℃ ) | 待测数据 |
| 1 | 8.00 | 2.00 | 500 | |
| 2 | 8.00 | 2.00 | 500 |
表二略,请回答:
上述实验中待测数据是
完成上述研究后,他们准备发表一篇研究报告,请你替他们一个
报告的题目:
20.(9分)(1)配平下列离子反应方程式
Fe(OH)3+ ClO-+ OH- ——→FeO4n-+ Cl-+ H2O
(2)已知有3.21gFe(OH)3参加反应,共转移了5.4×1022个电子,则n= ,FeO4n-
中铁元素的化合价为 。
(3)根据(1)、(2)推测,FeO4n-能和下列 (填序号)物质反应。
A.KMnO4 B.SO2 C.H2S D.O2
21.(12分)“绿色试剂”双氧水可作为矿业废液消毒剂,如要消除采矿业废液中的氰化物(如
KCN),化学方程式为:KCN+H2O2+H2O=A+NH3↑
(1)生成物A的化学式为 。
(2)在标准状况下有0.448L氨气生成,则转移的电子数为 。
(3)反应中被氧化的元素为 。
(4)H2O2被称为绿色氧化剂的理由是 。
22.
(10分) 阳离子Na+、Ag+、Mg2+、Cu2+和阴离子Cl-、NO![]() 、OH-、SO
、OH-、SO![]() 两两组成(不重复)A、B、C、D四种可溶性化合物,它们起反应时的现象如下:
两两组成(不重复)A、B、C、D四种可溶性化合物,它们起反应时的现象如下:
A+B→白↓,B+D→白↓,C+D→蓝↓
由此判断:A_________,B_________,C_________,D_________。(写化学式)
上述生成沉淀的离子方程式为:
①__________________________________。
②__________________________________。
③__________________________________。
23.(8分)固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。该物质适当加热就分解成两种气体。试回答下列问题:
(1)固体A属于______晶体,它的电子式为_________
(2)A溶于水后,溶液呈______性(酸、碱或中性),其原因是(化学方程式表示)________________________________________________________________.
24.(8分)已知下列两个热化学方程式;
H2(g)+![]() O2(g)===H2O(1); △H=-285.kJ/mol
O2(g)===H2O(1); △H=-285.kJ/mol
C3H8(g)+5O2(g)===3CO2(g)+4H2O(1); △H=-2220.0kJ/mol
(1)实验测得H2和C3H8的混合气体共5mol,完全燃烧生成液态水时放热6262.5kJ,则混
合气体中H2和C3H8的体积比是 。
(2)已知:H2O(1)=H2O(g);△H=+44.0kJ/mol
写出丙烷燃烧生成CO2和气态水的热化学方程式。
四、计算题
25.(14分)已知高锰酸钾、二氧化锰在酸性条件下能将草酸钠(Na2C2O4)氧化:
MnO![]() +C2O
+C2O![]() +H+→Mn2++CO2+H2O(未配平)
+H+→Mn2++CO2+H2O(未配平)
MnO2+C2O![]() +H+→Mn2++CO2+H2O(未配平)
+H+→Mn2++CO2+H2O(未配平)
为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g
草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所
得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,再用0.0200mol·L-1高
锰酸钾溶液进行滴定。当加入20.0mL溶液时恰好完全反应,问:
(1)欲求得软锰矿中二氧化锰的质量分数,还缺一个数据,这个数据是(填数据所代表
的意义);
(2)若该数据的数值为250.0,求该软锰矿中二氧化锰的质量分数。
参考答案
一、选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | C | D | C | B | B | D | A | D | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | B | AD | C | B | C | BD | AD | B | A |
三
19.时间,《催化剂A和二氧化锰性能的比较》。其他合理也可。
20.(1)2 5-n 2n 2 5-n n+3 (2)2 +6 (3)B、C
21.(1)KHCO3 (2)2.4×1022 (3)碳(C) (4)H2O2作氧化剂,其产物是H2O;H2O没有毒性及污染性。
22.AgNO3.MgCl2.CuSO4.NaOH.
(1)Ag++Cl-==AgCl↓
(2)Mg2++2OH-==Mg(OH)2↓
(3)Cu2++2OH-==Cu(OH)2↓
23.(1)离子 电子式为:
(2)碱性 ,NH4H + H2O===NH3·H2O + H2↑
24.(1)1:1;(2)C3H8(g)+5O2(g)===3CO2(g)+4H2O(g); △H=-2044.0kJ/mol
25.(1)这个数据是表示容量瓶的容量。
(2)n(Na2C2O4)=2.68g÷134g·mol-1=0.0200mol
n(KMnO4)=20.0mL×0.02mol·L-1=0.000400mol
0.0200mol×2=0.000400mol×5×250.0mL÷25.0mL+2×n(MnO2)
n(MnO2)=0.0100mol
该软锰矿中二氧化锰的质量分数=0.0100mol×87.0g·mol-1÷1.20g×100%=72.5%