高三化学分散系溶解度质量分数
☆双基知识
1、溶液、胶体与浊液三类分散系的比较
| 浊液
悬浊液 乳浊液 | 溶 液 | 胶 体 | |
| 定 义 | 固体小颗粒 小液滴悬浮悬浮于液体 于液体 | 一种或几种物质分散到另一种物质形成均一稳定混合物 | 分散质微粒直径在 10-9~10-7m之间的分散系 |
| 本质差别 | 分散质微粒直径>10-7m | 分散质微粒直径<10-9m | 分散质微粒直径在 10-9~10-7m |
| 性 质 | 不均一、不透明、不稳定,静置分层或颗粒下降 | 均一、透明、稳定, 无丁达尔现象 | 均一、透明、稳定,有丁达尔现象、布朗运动、电泳现象,可以凝聚。 |
| 能否透过滤 纸 | 悬浊液不能 | 能 | 能 |
| 能否透过半 透 膜 | 不能 | 能 | 不能 |
| 实 例 | 泥水、油水混合物 | 食盐水、碘酒 | Fe(OH)3 胶体 |
2、胶体的概念及有关性质
![]() ①概念:分散质粒子的直径介于10-9~10-7m之间的分散系
①概念:分散质粒子的直径介于10-9~10-7m之间的分散系
![]() 液溶胶:Fe(OH)3 胶体、H4SiO4 溶胶
液溶胶:Fe(OH)3 胶体、H4SiO4 溶胶
②分类: 气溶胶:雾、云、烟
固溶胶:有色玻璃
![]() 丁达尔现象——据此可区分溶液和胶体
丁达尔现象——据此可区分溶液和胶体
③性质: 布朗运动——实质上是一种无规则、无秩序的分子热运动
![]() 金属氧化物、金属氢氧化物的胶粒带正电。
金属氧化物、金属氢氧化物的胶粒带正电。
电泳现象——可证明胶粒
带有电荷 金属硫化物、非金属氧化物的胶粒带负电。
④凝聚方法:加热、加电解质、加带相反电荷胶粒的胶体
⑤净化方法——渗析
⑥用途:盐卤点豆腐,水泥硬化,作净水剂。
3、结晶、结晶水、结晶水合物、风化、潮解
具有规则几何外形的固体叫晶体;形成晶体的过程叫结晶。许多物质在水溶液中析出,形成晶体时,晶体里常结合一定数目的水分子,这样的水分子叫做结晶水;含有结晶水的物质叫做结晶水合物。
在室温时和干燥的空气里,结晶水合物失去一部分或全部结晶水的现象叫做风化。
晶体吸收空气里的水蒸气,在表面逐渐形成溶液,这个现象叫做潮解。
4、溶解度
固体、液体的溶解度:一定温下,100g溶剂中所能溶解溶质的最大质量(单位:g)
气体的溶解度:101KPa,一定温度下,1 体积水所能溶解气体的体积(无单位)
☆巧思巧解
1、基本公式
(1)![]() =
= ![]()
(2)![]() =
= ![]()
(3)ω = ![]() ×100%
×100%
2、换算
ω = ![]() ×100%
×100%
3、(1)对于降温,析出固体的物质的计算,一般可依下面公式:
 (2)对于升温,为保持饱和,需增加溶质的质量计算,一般可依公式:
(2)对于升温,为保持饱和,需增加溶质的质量计算,一般可依公式:
(3)对于析出结晶水合物的计算,需分清析出的晶体中溶质质量和水的质量,再依据剩余溶液仍然饱和的关系,应用上述公式,列式求解。
4、溶液的浓缩
(1)加入浓溶液
(2)加溶质
(3)蒸发蒸发溶剂(不适用于挥发性溶质,如盐酸、氨水)
【例】欲使5%的CuSO4 溶液A g变为10%的溶液,可采取下列措施:①加CuSO4 ②加CuSO4·5H2O ③加20%的CuSO4 溶液④蒸发溶剂。求上述四种情况下所需物质的质量。
☆例题精析
【例1】(全国2003-14)某温度下向100g澄清的饱和石灰水中加入5.6g生石灰,充分反应后恢复到原来的温度,则下列说法正确的是( )
A 沉淀的质量为5.6g
B 沉淀物的质量为7.4g
C 饱和石灰水的质量大于98.2g
D 饱和石灰水的质量小于98.2g
【例2】已知某盐在不同温度下的溶解度如下表.若把质量分数为22%的该盐溶液,由50℃逐渐冷却,则开始析出晶体的温度范围是( )
| 温度℃ | 0 | 10 | 20 | 30 | 40 |
| 溶解度 (g/100g水) | 11.5 | 15.1 | 19.4 | 24.4 | 37.6 |
A、0℃~10℃ B 、10℃~20℃ C 、20℃~30℃ D 、30℃~40℃
【例3】已知t℃时,某物质的不饱和溶液a g中含有溶质m g。若将该溶液蒸发b g水并恢复到t℃时,析出溶质m1 g ;若将原溶液蒸发c g水并恢复到t℃时,则析出溶质m2 g。S表示该物质在t℃时的溶解度,则下列正确的是( )
A 、 ![]() B、
B、![]()
C、![]() D、
D、![]()
【例4】如图是几种盐的溶解度曲线,下列说法正确的是( )
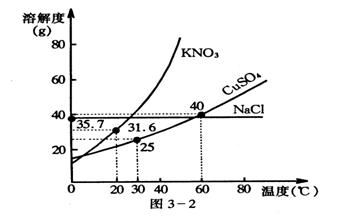 |
A、40℃时,将35g食盐溶于100g水中,降温至0℃时,可析出NaCl 晶体
B、20℃时,硝酸钾饱和溶液的质量分数是31.6%
C、60℃时,200g水中溶解80g硫酸铜达饱和。当降温至30℃时,可析出30g CuSO4 晶体D、30℃时,将35g KNO3 和35g NaCl 同时溶于100g水中,蒸发时,先析出的是NaCl 。
备选【例5】(1998年全国)下面是四种盐在不同温度下的溶解度(g/100g水)
| NaNO3 | KNO3 | NaCl | KCl | |
| 10℃ | 80.5 | 20.9 | 35.7 | 31.0 |
| 100℃ | 175 | 246 | 39.1 | 56.6 |
(计算时假定:①盐类共存时不影响各自的溶解度;②过滤晶体时,溶剂损耗忽略不计)
(1)取23.4g NaCl 和40.4g KNO3 ,加70.0 H2O ,加热溶解。在100℃ 时蒸发掉50.0g H2O ,维持该温度,过滤析出晶体,计算所得晶体的质量(m高温). 将滤液冷却至10℃, 待充分结晶后,过滤.计算所得晶体的质量(m 低温)。
(2)另取34g NaNO3 和29.8 KCl ,同样进行如上实验.10℃时析出的晶体是_________(写化学式).100℃和10℃得到的晶体质量(m’高温和m’低温)分别是多少?
【参考答案】
【例】①5A/18 g ②5A/54g ③0.5A g④0.5A g
【例1】D 【例2】D 【例3】 C 【例4】D
【例5】无