高三化学复习统测一 (基本概念)出题人:九江中学
说明:(全卷100分,选择题涂在答题卡上,第二卷写在答题卡指定位置,40分钟完成)
一、选择题(每题只有一个选项符合题意,每小题4分,共20分)
1、下列各项叙述正确的是( )
A、由同种元素组成的物质属于单质 B、具有相同质子数的粒子属于同种元素.
C、一种元素可有多种离子,但只有一种原子
D、有新单质生成的化学反应不一定都是氧化还原反应
2、 碘跟氧可以形成多种化合物,其中一种称为碘酸碘,在该化合物中,碘呈+3和+5两种价态,这种化合物的化学式是( )
 A、I2O3 B、 I2O4
C、 I4O7 D、 I4O9
A、I2O3 B、 I2O4
C、 I4O7 D、 I4O9
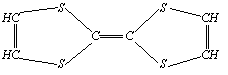
3、用来制造隐形飞机的某种物质具有吸收微波的功能,其
主要成分的结构如右图,它属于(
)
A、无机物 B、烃 C、高分子化合物 D、有机物
4、在FeCl3、CuCl2、FeCl2的混合溶液中,Fe3+、Cu2+、Fe2+的物质的量浓度比为3∶2∶1,现加入适量铁粉,充分反应后,溶液中三种离子的物质的量浓度比变为1∶2∶4,则参加反应的铁粉与原溶液Fe3+的物质的量之比为 ( )
A、2∶3 B、1∶2 C、1∶3 D、1∶4
5、下列离子在溶液中能大量共存,加入OH-能产生白色沉淀的是( )
A、Na+、Ca2+、SO42-、Cl- B、 H+、Mg2+、CO32-、S2-
C、K+、Mg2+、SO42-、NO3- D、K+、Na+、NO3-、SO32-
二、选择题(每题有1~2个选项符合题意,每小题4分,共24分)
6、将等体积、等物质的量浓度的NaHCO3溶液和Ba(OH)2溶液混合,反应的离子方程式正确的是( )
A、HCO3-+OH-==CO32-+H2O B、 2HCO3-+Ba(OH)2==BaCO3↓+2H2O+CO32-
C、HCO3-+Ba2++OH-==H2O+BaCO3↓ D、2HCO3-+Ba2++2OH-==2H2O+CO32- +BaCO3↓
7、已知热化学方程式:
2H2(g)+O2(g)===2H2O(l);ΔH=-571.6 kJ/mol
2H2O(g)===2H2(g)+O2(g);ΔH=+483.6 kJ/mol
当1 g液态水变为气态水时,其热量变化是:( )
①放出 ②吸收 ③2.44 kJ ④4.98 kJ ⑤88 kJ
A、②和⑤ B、①和③ C、②和④ D、②和③
8、某固体仅由一种元素组成,其密度为5g/cm3,用X射线研究该固体表明:在棱长为1.0X10-7cm的立方体中含有20个原子,则此原子的相对原子质量最接近( )
A、 32 B、65 C、120 D、150
9、用惰性电极电某硝酸盐R (NO3)n溶液,在阳极上产生VL气体(标准状况),在阴极析出W g金属R,则R的相对原子质量是( )
A、(VW)/22.4 B、(5.6nW)/22.4 C、(5.6VW)/22.4 D、(5.6nW)/V
10、将浓度为a%的NaOH溶液蒸发掉m克水后,变成2 a%的NaOH不饱和溶液v ml,所得溶液的物质的量浓度为( )mol/L
A、 B、 C、 D、
11、设NA为阿伏加德罗常数,下列说法正确的是()
A、标准状况下,22.4L氦气中含有2NA个氦原子 B、18g水中含有的电子数为9 NA
C、0.1mol Na2O2与水反应转移电子数为0.1NA
D、常温常压下,活泼金属从盐酸中转换出1molH2,发生转移的电子数为2 NA
三、填空题
12、(9分)一定量的液态化合物 XY2 , 在一定量的氧气中恰好完全燃烧, 反应的化学反应方程式如下: XY2(液) + 3 O2(气) = XO2(气) + 2 YO2(气). 冷却后, 在标准状况下测得生成物的体积是 672 ml, 密度是 2.56g/L, 则:
(1)反应前O2的体积是 mL;
(2)化合物XY2 的摩尔质量是 ;
(3)若XY2 分子中, X和Y两元素的质量比是 3 : 16, 则X、Y两元素分别为 。
13、(10分)某溶液中可能含有Na+、SO42-、SO32- 、CO32-、Cl—、Br—这几种离子中的若干种,依次进行下列实验,观察到的现象如下:
① 用pH试纸检验,溶液的pH>7;
② 向溶液中滴加氯水无气体产生,再加入CCl4振荡、静置,CCl4层呈橙色,用分液漏斗分液;
③ 向分液后所得的水溶液中加入Ba(NO3)2和HNO3的混合溶液,只有白色沉淀产生,过滤;
④在滤液中加入AgNO3和HNO3的混合溶液,有白色沉淀产生。
(1)原溶液中肯定有的离子是 ,肯定没有的离子是 。
(2)分液漏斗的上层液体如何转移到烧杯中? 。
(3)若步骤③改用BaCl2和盐酸的混合溶液,对判断结论有无影响? 。
(4)写出步骤②可能发生的有关反应的离子方程式 。
14、(14分)以下是有关氯气的几个实验:①实验室用二氧化锰和浓盐酸在加热条件下制取氯气②氯气溶于水中③用氢氧化钠吸收多余的氯气。
(1)上述反应的离子方程式依次为:
①
②
③
(2)上述反应中,每生成1mol氧化产物,转移电子的物质的量依次为
① ② ③ 。
(3)上述反应中,化合物作还原剂的反应是 号反应。
15、(16分)下面是测定硫酸铜晶体中结晶水含量的实验,请按要求填空。
(1)加热前应将晶体放在中 研碎,加热是放在 中进行,加热失水后,应放在 中冷却。
(2)判断是否完全失去结晶水的方法是 。
(3)做此实验,最少要进行重称量操作 次。
(4)下面是某同学的一次实验数据,请完成计算,将答案填入表的空格中。
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | 测得晶体中结晶水的个数 | 误差(偏高或偏低) |
| 11.7g | 22.7g | 18.6g |
(5)这次实验中产生误差的原因可能是 造成的。
A、硫酸铜晶体中含有挥发性的杂质 B、加热过程中有晶体溅出
C、实验前晶体表面有湿存水 D、最后两次称量质量相差较
高三化学复习统测一 (基本概念)出题人:九江中学
答题卡:
三、填空题
12、(8分)(1) mL;(2) ;(3) 。
13、(11分)(1) , 。
(2) 。
(3) 。(4) 。
14、(14分)(1)①
② ③
(2)① ② ③ 。 (3)
15、(16分)
(1) , , 。
(2) 。(3) 。
| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 | 测得晶体中结晶水的个数 | 误差(偏高或偏低) |
| 11.7g | 22.7g | 18.6g |
(4)
(5)
四、计算题(7分)
16、由Fe2O3、CuO组成的混合物32g溶于200mL硫酸溶液中,然后加入4mol/LNaOH溶液,开始无沉淀生成,当加入300mLNaOH溶液时恰好沉淀完全,求原硫酸溶液的物质的量浓度是多少?
参考答案
1、D 2、D 3、D 4、C 5、C 6、C 7、D 8、D 9、D 10、D 11、BD
12、(8分,每个2分)(1)672 mL(2)76 g·mol-1(3)C S
13、(11分,每空2分,(3)空1分)(1)Br-、Na+、SO32-,CO32—、
(2)打开分液漏斗活塞,将下层液体放出后,关闭活塞,使上层液体从漏斗口倒出
(3)无 (4)Cl2+SO32—+2H2O==2Cl—+SO42—+4H+ Cl2+2Br—===2Cl—+Br2
14、(14分,每空2分)(1)①MnO2+4H++4Cl―![]() Mn2++2Cl2↑+2H2O②Cl2+H2O=H++Cl-+HClO
Mn2++2Cl2↑+2H2O②Cl2+H2O=H++Cl-+HClO
③Cl2+2OH-==Cl-+ClO-+H2O (2)①2mol ②1mol ③1mol (3)①
15、(16分,每空2分)(1)研钵 坩埚 干燥器 (2)晶体由蓝色变为白色,不再有水蒸气产生,加热后最后两次误差不超过0.1g,
(3)4 (4)5.3 偏高(5)ABC
16、(7分)解:有关化学方程式为:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O CuO+H2SO4=CuSO4+H2O
H2SO4+2NaOH=Na2SO4+2H2O Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
可知:硫酸最终转化为Na2SO4 , (3分) 设硫酸物质的量浓度为x
相当式2NaOH~Na2SO4~H2SO4
2mol 1mol
4×0.3mol 0.2xL(2分)
x=4×0.3/2×0.2mol·L-1=3mol·L-1(2分)
答:硫酸溶液的物质的量浓度为3mol·L-1。