高三化学高考模卷
考试时间:120分钟 分值:150分
可能用到的相对原子质量:
H:1 Na:23 K:39 C:12 O:16 Cl:35.5 Cu:64
Ca:40 Mg:24 Al:27 Si:28 N:14 I:127 Fe:56
第Ⅰ卷(共74分)
一、选择题(共8小题,每小题只有正确一个选项,每小题4分,共32分。)
1、下列物质属于纯净物的是
A 溴水 B 重水 C 硬水 D 王水
2、漂尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2和O2接触时,使空气的酸度增加,漂尘所起的作用可能是
A 催化剂 B 还原剂 C 氧化剂 D 载体
3、铜片和锌片用导线连接后插入稀硫酸中,锌片是
A 阴极 B 正极 C 阳极 D 负极
4、已知阿伏加德罗常数,物质的摩尔质量及摩尔体积,下列物理量中尚不能全部计算出近似值的是
A 固体物质分子的大小和质量 B 液态物质分子的大小和质量
 C 气态物质分子的大小和质量 D 气态物质的分子质量
C 气态物质分子的大小和质量 D 气态物质的分子质量
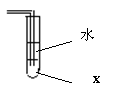
5、有人设计右图装置吸收氯化氢气体或氨气能取得良好的效果
(能有效防止倒吸)。由图可推测(X)可能是
A. 苯 B. 甘油 C. 四氯化碳 D. 苯胺(C6H5-NH2)
6、从海水中提取溴有如下反应:5NaBr+NaBrO3+3H2SO4==3Br2+3Na2SO4+H2O与上述反应在氧化还原反应原理上最相似的是
A SO2+2H2S==3S+ H2O B CaCO3+CO2+H2O== Ca(HCO3)2
C CH3COOH+CH3CH2OH→CH3COOCH2CH3+H2O D 2FeCl3+Fe===3FeCl2
7、化合价为n的某元素的硝酸盐的式量为x,其氢氧化物的式量为y,则n的值是
A(x-y)/45 B(y-x)/45 C(x-y)/79 D (y - x)/79
8、碘跟氧可以形成多种化合物,其中一种称为高碘酸碘,在该化合物中,碘元素呈+3和+7两种价态,这种化合物的化学式是
A、I2O3 B、I2O4 C、I4O7 D、I4O12
二、选择题(共10小题,9-16题每小题4分,17、18小题每题5分共42分。每题有1-2个选项符合题意。)
9、以NA表示阿伏加德罗常数,下列说法正确的是
A 0.1 mol H3O+中含有NA个电子 B 标准状况下,11.2L臭氧中含有NA个氧原子![]()
C 2g重氧水(H218O)含有NA个中子 D 84gNaHCO3晶体中含有NA个CO32-
10、抗“非典”斗争中,消毒液需求量猛增,某单位设计了一种家用消毒液发生器。该发生器利用常见的精盐和自来水为反应物,通电时,发生器电解槽里的极板上产生大量气泡,切断电源后所得消毒液具有较强的杀菌能力,且对人体无害,在发生器内发生的反应是
A、2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ B、H2+Cl2
2NaOH+H2↑+Cl2↑ B、H2+Cl2![]() 2HCl
2HCl
C、Cl2+2NaOH=NaCl+NaClO+H2O D、NaClO+HCl=NaCl+HClO
11、实现下列变化既不需要另加入还原剂,也不需要另加入氧化剂的是
A F2→F- B HNO3→NO C Mg→Mg2+ D Na2O2→O2
12、下列说法正确的是
A 电解NaOH溶液时,溶液浓度将减小,pH增大
B 电解H2SO4溶液时,溶液浓度将增大,pH减小
C 电解Na2SO4饱和溶液时,溶液浓度将增大,pH不变
D 电解NaCl溶液时,溶液浓度将减小,pH不变
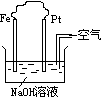 13、关于右图装置中的叙述正确的是
13、关于右图装置中的叙述正确的是
A 这是电解NaOH溶液的装置
B 这是一个原电池装置
C Pt为正极,其电极反应为:2H2O+O2+4e-=4OH—
D Fe为负极,其电极反应为:4OH- - 4e-=H2O+O2↑
14、常温下,在含有H+、SO42-、Fe2+的溶液中,加入下列离子后,溶液中各种离子仍能大量共存的是 A ClO- B AlO- C HCO3- D I-
15、两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,两容器内的气体质量相等,下列说法正确的是:
A 它们的分子数一定相同 B 它们的密度一定相同
C 它们一定具有相同的(平均)分子量 D 它们的压强一定相同
16、下列描述属于物质的物理性质的是
A 碳酸的不稳定性 B 盐酸的易挥发性
C CO的毒性 D 浓硫酸的吸水性
17、t℃时,在V
mL密度为d ![]() 的
的![]() (相对分子质量为M)饱和溶液中,加入足量的NaOH溶液,充分反应后过滤(假设滤液无损失),在滤液中加入适量硝酸使溶液呈中性后,再加入4 mL 1.0 mol/L的
(相对分子质量为M)饱和溶液中,加入足量的NaOH溶液,充分反应后过滤(假设滤液无损失),在滤液中加入适量硝酸使溶液呈中性后,再加入4 mL 1.0 mol/L的![]() 溶液恰好完全反应,则t℃时
溶液恰好完全反应,则t℃时![]() 的溶解度
的溶解度
A ![]() B
B ![]() C
C ![]() D
D ![]()
18、周期表中有些元素有“对角线相似”现象(即周期表中处于对角线位置的两元素性质相似),如Li与Mg;Be与Al;B与Si等两两性质相似。现用熔融LiCl电解的方法可得锂和氯气。若用已潮解的LiCl加热蒸干并强热至熔融,再用惰性电极电解,结果得到金属锂和一种无色无味的气体。据此,下列说法正确的是
A、无色气体为电解生成的锂与水反应放出的H2 B、电解时产生的无色气体是O2
C、电解前LiCl在加热时已发生水解 D、无色气体是阳极放出的Cl2与水作用生成的O2
将正确的答案填入下表中
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 |
| 序号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
第Ⅱ卷(共76分)
三、(本题共2小题,共13分)
19、(4分)(1)指出下列使用仪器或用品的第一步操作:
托盘天平: 。
红色石蕊试纸: 。
(2)指出做下列实验时,从安全角度考虑必须进行的实验操作或加入的实验用品:
点燃氢气 。
石油分馏(课堂演示) 。
20、(9分)实验室用铜和硫酸制取CuSO4有几种方法:
Ⅰ、甲学生进行了下列实验:取6.4g铜片和10mL18mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余。他根据自己所学的化学知识,认为烧瓶中还有较多的硫酸剩余。他这样认为的理由是: .
|
Ⅱ、乙同学认为甲设计的实验方案不好,他自己设计的思路是2Cu+O2 2CuO;CuO+H2SO4 CuSO4+H2O。对比甲的方案,乙同学的优点是:
Ⅲ、为了同样达到乙同学的优点,你能不能根据电化学原理也设计一个用铜和硫酸制取CuSO4的方案?(其它材料任选)
四、(本题共2小题,共23分)
21、(12分)能源可划分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级
能源;需依靠其它能源的能量间接制取的能源称为二级能源;氢气是一种高效而没有污染的二级能源,它可由自然界中的水来制取:2H2O(l)=2H2(g)+O2(g) △H= + 517.6KJ/ mol
(1)下列属于一级能源的是 。
A 电能 B 水力 C 天然气 D 焦炉气 E 风能 F 氢氧燃料电池
(2)已知:CH4(g)+2O2(g)=2H2O(l)+CO2(g) △H= -890.3千焦,18gH2和CH4(该混合气的平均相对分子质量为9),充分燃烧后,放出的热量为 KJ
(3)关于用水制取二级能源氢气,以下研究方向正确的是 。
A 构成水的氢和氧都是可燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源
B 设法将太阳光聚集,产生高温,使水分解产生氢气
C 寻找高效催化剂,使水分解产生氢气,同时释放能量
D 寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
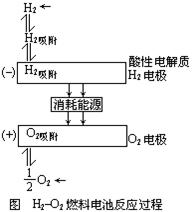 (4)燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。人们已将它应用于航天飞行器上。 下图为氢氧燃料电池反应的完整过程
(4)燃料电池的基本组成为电极、电解质、燃料和氧化剂。此种电池能量利用率可高达80%(一般柴油发电机只有40%左右),产物污染也少。人们已将它应用于航天飞行器上。 下图为氢氧燃料电池反应的完整过程
请将左图方框中的电极反应填补完整:
H吸附______________________________,
O2吸附______________________________;
(5)在理论上不能设计原电池的化学反应是 。
A HCl+NaOH==NaCl +H2O △H<0
B 2CH3OH(l)+3O2(g)==2CO2(g)+4H20(l) △H<0
C 4Fe(OH)2(s)+2H2O(l)+O2(g)=== 4Fe(OH)3(s) △H<0
D 2H2(g)+O2(g)=== 2H2O △H<0
|
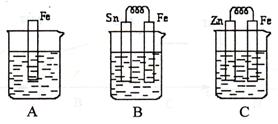
(1)A中反应的离子方程式为 。(2分)
(2)B中Sn极的电极反应式为 ,(2分)
Sn极附近溶液的pH(填“增大”、“减小”或“不变”) 。(2分)
(3)比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是 。(2分)
(4)有A、B、C、D四种金属,将A、B用导线连接后浸入稀H2SO4中,A上放出氢气,B逐渐溶解生成B2+;电解含A2+和C2+的混合溶液时,阴极上先析出C;将D放入含B2+的硝酸溶液中,D表面有B析出,同时生成D2+。则这四种金属阳离子的氧化性由强到弱的顺序为__________________________________。(3分)
五、(本题共2小题,共18分)
23(6分)A、E为短周期元素的单质,B、C为化合物,他们之间的转化关系如下图所示:
A →B →C
C溶于水且能产生气体,回答下列问题,写出全部可能的情况(写化学式)
第一种情况:A B C 。
第一种情况:A B C 。
第一种情况:A B C 。(可以不填满,也可补充)
24、(12分) A、B、C、D、E、F、G、H、I分别代表九种不同的有机物(其中A是化学工业重要原料之一).它们之间的相互转化关系如下图,请回答下列问题:
(1)A的结构式为________ ________;F的结构简式为_________ _______________;
(2)写出下列转化的化学方程式①C→D________________________________________,
②G→H_________________________________________________________________.
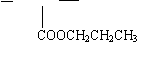 ( 3)已知有机物 [CH2-CH]n
的透气性比
( 3)已知有机物 [CH2-CH]n
的透气性比![]() 好.做为隐形眼镜的材料,
好.做为隐形眼镜的材料,
应该具有良好的透气性和亲水性,请从H的结构上分析它可以作为隐形眼镜材料的原因:
.
 五、(本题共2小题,共22分)[Fe-56,Cu-64,O-16]
五、(本题共2小题,共22分)[Fe-56,Cu-64,O-16]
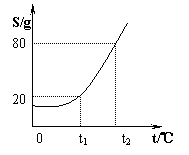
25、(6分)(1)某物质A的溶解度曲线如图所示:
在t2℃时,在50g水中放入45gA溶质,所得饱和溶液的
质量是 。将所得溶液从t2℃降温至t1℃时
将析出 g无水A。(计算过程省略)
(2)(4分)在一定温度下,某饱和碳酸钠溶液中碳酸钠的质量分数为w % ,加入a g无水碳酸钠可析出 b g碳酸钠晶体(Na2CO3·H2O) ,则溶液中溶质减少的质量为多少?(用
题目中出现的字母表) 。
26、(12分)已知常温时反应:2Fe3++Cu==2Fe2++Cu2+ 在水溶液中能够发生,将22.4g由铜和三氧化二铁组成的混合粉末加入到浓度为1mol/L的硫酸中发生相应反应。
(1)若固体恰好完全溶解,消耗硫酸的体积为V,求V 的取值范围
(2)若硫酸溶液过量,反应后体积为1L,测得此溶液中的Fe2+的浓度为0.1mol/L,求原混合物中含铜的质量。
参考答案
| 序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | B | A | D | C | C | A | A | D |
| 序号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AC | AC | D | B | BC | D | B | BD | D | BC |
19、(1)调零(调节天平平衡) (用蒸馏水)湿润石蕊试纸
(2)检验纯度 放入少量碎瓷片
20、Ⅰ 随着反应进行,浓硫酸浓度逐渐变小,稀硫酸不再与铜发生反应(3分)
Ⅱ 乙消耗的硫酸的物质的量更少,不产生污染物SO2(3分,答一点只得1分)
Ⅲ 以铜为阳极、碳(Fe、Pt)电极为阴极,电解硫酸溶液 (3分)
21、(1)BCE (2)1149.1KJ (3)BD
(4)2H2-4e- =4H+ O2+4H++4e-=2H2O (5)A (每空2分,漏选得1分)
22、(1)Fe+2H+=Fe2++H2↑ (2)2H++2e=H2↑ 增大 (3) B、A、C
(4)D>B>A>C [(1)-(3)每空2分,(4)每空3分]
23、第一种情况:A:N2 B:NO C:NO2 第二种情况:A:Na B:Na 2O C:Na 2O2
24、 (1)(每空2分) 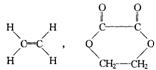
(2)①![]() 3分
3分
② (3分,不写n不得分,不写条件扣2分)
(3分,不写n不得分,不写条件扣2分)
(4)由于高分子中支链大,高分子之间间距就大,所以有良好的透气性(1分),分子中有许多羟基,所以有良好的亲水性(1分).
25、(1)90g 30g (2)(53b/143 - a) g (b-a)w% g
26、(1)固体完全溶解涉及的反应:
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Fe2(SO4)3+Cu=2FeSO4+CuSO4
若固体中只有Fe2O3恰好反应时有:
1mol/L×V1=3×22.4g/160g·mol 解得V1=0.42L
若固体中有Cu和Fe2O3恰好反应时:
n(Cu)=n(Fe2(SO4)3)=n(Fe2O3) 即 22.4=64x+160x 得x=0.1mol 所以V2=3×0.1/1=0.3L
所以,V的取值范围是0.3L≤V<0.42L
(2)讨论:若Cu过量,则n(Fe2(SO4)3)=n(Fe2O3)=1/2 n(FeSO4)=0.05mol
Cu的质量为22.4 g –0.05mol×160g/mol=14.4g
若Fe2(SO4)3过量则n(Cu)= 1/2 n(FeSO4)=0.05mol Cu的质量为 0.05mol×64g/mol=3.2g