高三化学考前放松训练
一、选择题(每小题只有一个选项符合题意。)
1.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtW ü thrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是
A 13C与15N有相同的中子数 B 13C与C60互为同素异形体 ( )
C 15N与14N互为同位素 D 15N的核外电子数与中子数相同
2.下列实验中,仪器的下端必须插入液面下的是 ( )
①制备氢气的简易装置中的长颈漏斗; ②制备氯气装置中的分液漏斗;
③制备Fe(OH)2操作中的胶头滴管; ④制乙酸乙酯时插入碳酸钠溶液中的导管
⑤用乙醇制取乙烯时的温度计; ⑥分馏石油时的温度计
A ①③⑤ B ②④⑥ C ①③④⑤ D 全部
3.下列各组物质的性质比较,从强到弱的顺序正确的是 ( )
A 单质熔点:Li>Na>K>Mg>Al B 酸性:HClO4>H2SO4>H3PO4 >H2SiO3
C 稳定性:AsH3>PH3>NH3 D 沸点:HI>HBr >HCl>HF
4.用0.01mol·L-1NaOH溶液完全中和pH=3的下列溶液各100mL。需NaOH溶液的体积最大的是 ( )
A 盐酸 B 硫酸 C 高氯酸 D 醋酸
5.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是 ( )
A H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B 2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D 2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
6. 下列说法中,正确的是(用NA表示阿伏加德罗常数值) ( )
A 常温常压下,1mol氖气含有的核外电子数是20NA
B 32g氧气和32g臭氧所含氧原子数都为2NA
C 18g水中所含的电子数是8NA
D 标准状况下,1L戊烷完全燃烧后生成的二氧化碳的分子数是5NA/22.4
二、选择题(每小题只有一个或两个选项符合题意。)
7. 晶体可以分为分子晶体、离子晶体、原子晶体等,在以下①②两个题目中,分别对不同晶体的组成、微粒间的作用力以及晶体的几何构型等进行了描述,请根据各题的提问做出选择:
①下列关于只含非金属元素的化合物的说法正确的是( )
A 一定是共价化合物,且只能构成分子晶体;
B 其晶体不可能是离子晶体,因为微粒间的作用力只有分子间作用力;
C 其晶体不可能是原子晶体,原子晶体只有非金属单质,没有化合物;
D 可能是离子化合物。
②有下列离子晶体空间结构示意图:●为阳离子,○为阴离子。以M代表阳离子,N代表阴离子,化学式为MN2的晶体结构为( )
A 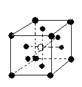 B
B 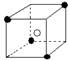 C
C 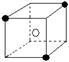 D
D 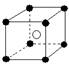
8.将20mL 0.4mol/L硝酸铵溶液跟50mL 0.1mol/L氢氧化钡溶液混合,则混合溶液中以下各 正确的是 ( )
A C(NO3-)>C(OH-)>C(NH4+)>C(Ba2+)
B C(NO3-)>C(Ba2+)>C(OH-)>C(NH4+)
C [Ba2+]+[NH4+]+[H+]=[NO3—]+[OH—]
D 2C(Ba2+)+C(NH4+)+C(H+)=C(NO3—)+C(OH—)
9. 下列除去杂质的方法正确的是 ( )
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| B | NaHCO3 | Na2CO3 | / | 加热 |
| C | Fe | Al | 氢氧化钠溶液 | 过滤 |
| D | Fe(NO3)2 | Ba(NO3)2 | 硫酸 | 过滤 |
10. 某金属硝酸盐受热分解生成金属氧化物、二氧化氮和氧气。若生成的二氧化氮和氧气的物质的量之比为8∶1,则金属元素的化合价在反应过程中的变化是( )
A 升高 B 降低 C 不变 D 无法确定
三 实验题
11.(9分) 请回答下列(1)、(2)两小题
(1)化学家庭小实验是利用家庭日常生活用品进行化学学习和研究的活动,利用日常生活用品,下列实验设计无法完成的实验是 (填字母代号)。
A.粥汤检验碘盐中是否含有KIO3 B.除去热水瓶中的水垢
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污 D.淀粉溶液具有丁达尔现象
E.自制少量氢气 F.检验液化气钢瓶阀门处是否漏气
(2).某学生将混有铜粉的氯化铁晶体(FeCl3.6H2O),提纯,以得到纯净的氯化铁晶体,他提出了下列实验步骤:a、把样品溶解;b、过滤除去铜粉; c、蒸干溶液即得氯化铁晶体
(1)以上是否步骤可行? 其原因是(请写出必要的文字说明和有关的反应方程式)
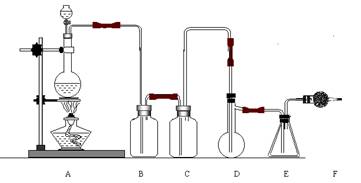 12.二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
12.二氯化硫(SCl2)熔点-78℃,沸点59℃。密度1.638。遇水易分解。二氯化硫与三氧化硫作用可生成重要化工试剂亚硫酰氯(SOCl2)。以下是由氯气与硫反应合成二氯化硫的实验装置。
试回答下列:
(1)装置A中发生反应的化学方程式为: 。
(2)装置B盛放的药品是 C中是 。
(3)实验开始前先在D中放入一定量的硫粉,加热使硫熔化,然后转动和摇动烧瓶使硫附着在烧瓶内壁形成一薄层表面,这样做的目的是 。
(4)实验时,D装置需加热至50-59oC,最好采用何种方式 加热 。如何防止E中液体挥发 。
(5)F装置中干燥管内所盛物质是 作用是: 。
四.有机化学题
13.今有化合物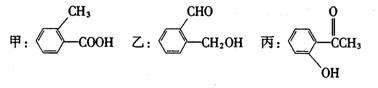
(1)请写出乙中含氧官能团的名称:___________________;
(2)请分别写出鉴别甲、丙化合物的方法(指明所选试剂及主要现象即可):
鉴别甲的方法:________________________________________________________;
鉴别丙的方法:________________________________________________________;
(3)请按酸性由强至弱排列甲、乙、丙的顺序:___________________________;
(4)请判别上述哪些化合物互为同分异构体:_____________________________;
(5)丙有很多同分异构体,请写出含有酯基和一取代苯结构的同分异构体结构简式两个_________________________________、__________________________________。
14. 如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:
3A(g)+2B(g)![]() C(g)
C(g)![]() +2D(g);ΔH<0
+2D(g);ΔH<0
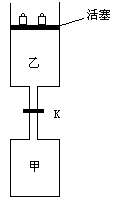 达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
达到平衡(Ⅰ)时,V(乙)=0.86V L。请回答:
(1)乙中B的转化率为 ;
(2)甲中D和乙中C的物质的量比较: (填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为 (用含V的代数式表示,连通管中气体体积忽略不计。)
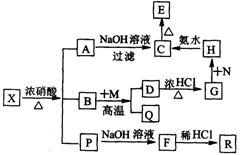 15.有一固体X它由两种常见元素组成,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。B常温下为无色液体。P为混合物气体,R是无色无味能使澄清石灰水变浑浊的气体。C为红褐色物质,M为常见金属单质。
15.有一固体X它由两种常见元素组成,其中金属元素与另一元素的质量比为14:1。在一定条件下X可发生下列转化,有的反应标出全部产物,有的反应标出部分产物。B常温下为无色液体。P为混合物气体,R是无色无味能使澄清石灰水变浑浊的气体。C为红褐色物质,M为常见金属单质。
试填空:
(1)X的化学式为 。
(2)G转化为H时不引入新杂质,N最好选择适量下列物质中的 (填序号)
a.KMnO4 b.HNO3 c.H2O2 d.C12
(3)写出反应的离子方程式:
G中通入Cl2 ; H+C 。
(4)B+M反应的化学方程式: 。
16.(8分)氨气极易溶于水,人们把氨气溶于水得到的溶液称为氨水。
(1)将标准状况下11.2L氨气溶于100mL水中,得到密度为0.860g·cm-3的氨水。求所得氨水的物质的量浓度。
(2)将上述30mL氨水与70mL2mol·L-1的AlCl3溶液混合,生成的沉淀质量为ag,求a的值。
(3)往上述反应后未过滤的浊液中加入VmL5mol·L-1的NaOH溶液后,得到沉淀物的质量仍为ag,求V的值。
考前放松训练参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| C | A | B | D | A | B | DB | BD | AC | A |
11 (1)A (2) 否 ①引入了铜离子② 加热蒸干,三价铁离子水解 (方程式略)
12.(1)MnO2 +4HCl(浓) ![]() MnO2 +Cl2↑+2H2O (2)饱和食盐水(或水),浓硫酸
MnO2 +Cl2↑+2H2O (2)饱和食盐水(或水),浓硫酸
(3)增大反应接触面(4)水浴加热,并用温度计控制温度;将锥形瓶放入冰水中冷却
(5)碱石灰(或固体氢氧化钠或生石灰);防止空气中水蒸气进入并吸收残留余的氯气。
13.答案:略
14.(1)20%(4分)(2)后者大 (2分) (3)0.29V(4分)18.
15. (10分)(1)Fe3C (2)cd
(3) 2Fe2++Cl2=== 2Fe3++2Cl- Fe3++3NH3·H2O==Fe(OH)3↓++3NH4+
![]()
16.(1)所得氨水的物质的量浓度为:4.00mol/L
(2) 根据计算, Al3+ 过量。所以,a= 3.12g
(3)根据Al3+ 、NH4+ 、Al(OH)3 结合OH—离子的难易顺序,应该是Al3+ 先与OH—离子反应而后是NH4+ ,铵根反应完了,才是Al(OH)3 与OH—离子反应。因此,实际的情况是0.10molAl3+ 与OH—离子结合成Al(OH)3 后(这时消耗NaOH 0.30mol),0.12molNH4+再与OH—离子生成 NH3·H2O(这时消耗NaOH 0.12mol),最后将最初产生的0.1molAl(OH)3溶解这时消耗NaOH 0.10mol 。因此共消耗NaOH 0.52mol,计算体积是104mL。