高三化学第五周周练试卷
一.选择题(共8小题,每小题4分,每小题只有一个答案符合题意)
1.常温下某溶液中由水电离的c(H+)=10—10mol·L—1,该溶液中溶质不可能是( B )
A.NaHSO4 B.Al2(SO4)3 C.NaOH D.HCl
2.相同温度下等物质的量浓度的下列溶液中,pH值最小的是 ( C )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
3.正常人胃液的pH在0.3~1.2之间,酸(一般以盐酸表示)多了,需要治疗.某些用以治疗胃酸过多的药物中含![]() 、
、![]() ,还有用酒石酸钠来治疗.这主要是由于C
,还有用酒石酸钠来治疗.这主要是由于C
A.对人体而言酒石酸是营养品 B.![]() 、
、![]() 都是人体必需的元素
都是人体必需的元素
C.碳酸、酒石酸都不是强酸
D.MgCO3和NaHCO3与胃酸作用生成![]() ,在服药后有喝汽水的舒服感
,在服药后有喝汽水的舒服感
4.为了更合理地表示溶液的酸碱性,科学家提出“酸度”(用AG表示)概念,
AG=lg![]() .下列叙述正确的是
( A )
.下列叙述正确的是
( A )
①任何温度下,水的AG等于0 ②溶液的AG越小,酸性越强
③常温下,0.1mol·![]() 盐酸的AG=12
盐酸的AG=12
④25℃时,某溶液的AG=-10,其pH=10
![]() A.①③ B.②④ C.①② D.③④
A.①③ B.②④ C.①② D.③④
5.把Ca(OH)2放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s) Ca2++2OH-下列说法正确的是 ( C )
A.恒温下向溶液中加CaO,溶液的pH升高 B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变
6.健康人血液的pH总是维持在7.35~7.45之间,这是由于 ( D )
A.人体内含有大量水分 B.血液中NaCl的含量保持恒定不变
C.人体排出的酸性物质与碱性物质部分溶解在血液中
D.血液中![]() 和
和![]() 只允许在一定的比例范围
只允许在一定的比例范围
7.下列方法能使电离平衡![]()
![]()
![]() 向右移动,且使溶液呈酸性的是(B )
向右移动,且使溶液呈酸性的是(B )
A.向水中加入少量硫酸氢钠固体 B.向水中加入少量硫酸铝固体
C.向水中加入少量碳酸钠固体 D.将水加热到100℃,使水的pH=6
|
然后用滴定管向容器里滴入甲溶液。随着甲的滴入,
电灯渐渐变暗。滴到一定量时,电灯熄灭。继续滴入
甲溶液,电灯又会逐渐亮起来。下列各组溶液中
(甲在前,乙在后),能够产生上述现象的是(D )
A.NH3·H2O、AgNO3
B.CH3COOH、NH3·H2O
C.NaOH、AlCl3 D.H2SO4、Ba(OH)2
9.常温下,将pH=1的硫酸溶液平均分成两等份,一份加入适量水,另一份加入与该硫酸溶液物质的量浓度相同的氢氧化钠溶液,两者pH都升高了1,则加入水和加入NaOH溶液的体积比约为 (C )
A.11:1 B.10:1 C.6:1 D.5:1
10.将相同物质的量浓度的某弱酸HX与NaX溶液等体积混合,测得混合溶液中C(Na+)>C(X-),则下列关系错误的是 (AB )
A.C(OH-)<C(H+) B.C(HX)<C(X-)
C.C(HX)+C(x-)=2C(Na+) D.C(H+)+(Na+) C(X-)+C(OH-)
11.某酸式盐NaHY的水溶液显碱性,下列叙述正确的是 ( C )
A.![]() 的电离方程式:
的电离方程式:![]()
![]()
![]()
B.![]() 离子的水解方程式:
离子的水解方程式:![]()
![]()
![]()
C.该酸式盐溶液中离子浓度关系:![]()
D.该酸式盐溶液中离子浓度关系:![]()
12.已知某溶液中存在![]() ,
,![]() ,
,![]() 和
和![]() 四种离子,其浓度大小有如下关系,其中可能的是
( C )
四种离子,其浓度大小有如下关系,其中可能的是
( C )
①![]() ②
②![]()
③![]() 且
且![]() ④
④![]()
⑤![]()
A.①④ B.③⑤ C.①②③ D.④⑤
13.下列各溶液中,微粒物质的量浓度关系正确的是 ( D )
A.![]() 溶液中
溶液中 ![]()
B.![]() 溶液中:
溶液中:![]()
C.![]() 溶液中:
溶液中:![]()
D.![]() 溶液中:
溶液中:![]()
14.常温时,将![]() 的氨水滴加到
的氨水滴加到![]() 的盐酸中,正确的是A
的盐酸中,正确的是A
A.若混合溶液的pH=7,则![]()
B.若![]() ,
,![]() ,则混合液中
,则混合液中![]()
C.若混合液的pH=7,则混合液中![]()
D.若![]() ,且混合液的pH<7,则一定有
,且混合液的pH<7,则一定有![]()
15. 现有甲、乙、丙、丁和氢氧化铁五种胶体,按甲和丙、乙和丁、丙和丁、乙和氢氧化铁胶体两两混合,均出现凝聚,则胶粒带负电荷的胶体是 ( B )
A甲、乙 B乙、丙 C丙、丁 D甲、丁
16.t℃时,将某烧碱溶液蒸发掉8.2g水后,恢复至t℃,析出5.8gNaOH·H2O晶体。再蒸发1.2g水后,恢复至t℃又析出5.8gNaOH·H2O晶体。则t℃时NaOH的溶解度约为 ( B )
A 40.0g B 133.0g C 333.3g D 483.3g
 17.
17.
|
| |
A.
|
B.
|
|
C.
|
D.
|
|
|
|
率为V(CO2)=0.1mol/L·min
![]() 18、1mol X气体和a molY气体在体积可变的密闭容器中发生如下反应
18、1mol X气体和a molY气体在体积可变的密闭容器中发生如下反应
X(g)+aY(g) b B(g) 反应达到平衡时,测得X的转化率为50%,而且同温同压下 还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数可能分别是( AD )
 A.1、1
B.2、1
C.2、2 D.3、2
A.1、1
B.2、1
C.2、2 D.3、2
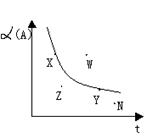
![]() 19.如图所示是其他条件一定时,反应2A+B 2C;△H<0, A的最大转化率与温度关系曲线,下列叙述中正确的是AB
19.如图所示是其他条件一定时,反应2A+B 2C;△H<0, A的最大转化率与温度关系曲线,下列叙述中正确的是AB
A.X或Y两点V正=V逆
B..Z、N两点表示未达平衡状态,且都是V正>V逆
C..W点表示非平衡状态V正>V逆
D.相应反应速率大小是W>Y>N
20.在相同温度时100m L0.01mol/L的醋酸溶液与10m L 0.1mol/l的醋酸溶液相比,下列数值前者大于后者的是(BC )
A.中和时所需NaOH的量 B.电离度
C.H+的物质的量 D.CH3COOH的物质的量
21.将PH=5的硫酸溶液稀释500倍,稀释后溶液中C(SO42-)和C(H+)之比约为 ( C )
A.1:1 B.1:2 C.1:10 D.10:1
一.选择题 班级__________姓名__________考号_________
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | |||||||
| 题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | |||||||
| 题号 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 答案 |
二.填空题
22. 0.01mol/L的硫酸氢钠溶液的pH为 ,在其中滴入等体积的pH=12的Ba(OH)2溶液后,所发生反应的离子方程式为 。
23.相同温度下的三种溶液:①硫酸 ②醋酸 ③盐酸。
(1)当物质的量浓度相等时,三种溶液的pH由大到小的顺序是(用序号表示,下同)
。
(2)取pH都等于3的①、②、③三种溶液各100mL,分别向其中各加入10mL pH=12的
Ba(OH)2溶液,充分反应后混合液pH最小的是 。
24.(8分)在0.5mol·L-1纯碱溶液中滴入酚酞试液变红,若在该溶液中再逐滴滴入过量BaCl2溶液,所观察到的现象是_________________________________________
其原因是(用离子反应方程式和简要文字说明)_____________________________:
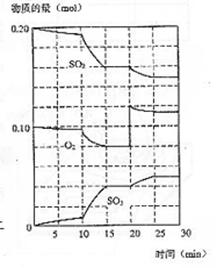 25.在一定条件下,二氧化碳和氧气发生如下反应:
25.在一定条件下,二氧化碳和氧气发生如下反应:
![]() 2SO2(g)+ O2 (g) 2SO3(g) ;△H<0
2SO2(g)+ O2 (g) 2SO3(g) ;△H<0
(1)降低温度,二氧化碳转化率 ,化学反应速度 (以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化碳和氧气混合, 反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是 。
(3)据图判断,反应进行至20min时,曲线发生变化的原因是_______________________(用文字表达),10min到15min的曲线变化的原因可能是 (填写编号)。
a.加了催化剂 b.缩小容器体积
c.降低温度 d.增加SO3的物质的量
![]() 26.反应a A(g)+b B(g)
c C(g)+d D(g)在容积不变的密闭容器中达到平衡,且起始时A、B的物质的量之比为a:b。则
26.反应a A(g)+b B(g)
c C(g)+d D(g)在容积不变的密闭容器中达到平衡,且起始时A、B的物质的量之比为a:b。则
①平衡时A、B的转化率之比为__________;
②若同等倍数地增大A、B的物质的量浓度,要使A、B的转化率同时增大,(a+b)与(c+d)所满足的关系是a+b______c+d (填>、<、=或没关系)
③设定a=2,b=1,c=3,d=2,在甲、乙、丙 丁4个容器中A的物质的量依次是2mol、1mol、2mol、1mol,B的物质的量依次是1mol、1mol、2mol、2mol,C、D的物质的量均为0。则相同温度下达到平衡时A的转化率最大容器是___________,B的转化率由大到小的顺序是(填容器序号)____________
三.计算题
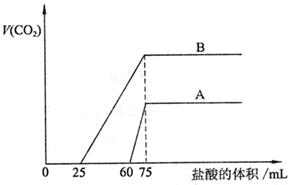
27.取等物质的量浓度的NaOH溶液两份A和B,每份50mL,向其中各通入一定
量的CO2,然后各取溶液10mL,分别将其稀释为100mL,分别向稀释后的溶液中逐滴
加入0.1mol/L的盐酸,标准状况下产生CO2气体体积与所加盐酸体积之间的关系如下图
|
(1)曲线A表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质的物质的量之比为 ;加盐酸后产生CO2体积的
最大值为 mL。
(2)曲线B表明,原溶液中通入CO2后,所得溶液中的溶质为(写化学式)
,两种溶质物质的量之比为 ;加盐酸后产生CO2体积最
大值 mL。
(3)通过计算求出原NaOH溶液的物质的量浓度。
参考答案
一.选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | B | C | A | C | D | D | B | B | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | D | C | C | AB | C | C | D | A | B | AD |
19.(1)2;2H++SO42-+Ba2++2OH-====BaSO4↓+2H2O
(2)Fe—2e-=Fe2+; 2H2O+O2+4e-=4OH-
(3)浓盐酸;MnO2+4HCl(浓)=MnCl2+Cl2+2H2O(加热)
(4)防止Hg2+水解生成沉淀;Hg2++2H2O=Hg(OH)2↓(或HgO)+2H+(加热)
20.![]()
![]()
![]() 1∶6 由
1∶6 由![]() 转化为
转化为![]() 需
需![]() ,
,![]() 由
由![]() 提供(水解),现因
提供(水解),现因![]() 量不变,只能生成
量不变,只能生成![]() ,没有
,没有![]() ,喷不出泡沫,另外,
,喷不出泡沫,另外,![]() 表面生成
表面生成![]() 后,阻碍反应的进行
后,阻碍反应的进行![]() 水解产生的
水解产生的![]() 会腐蚀铁筒
会腐蚀铁筒
21(1)否
若a=3,则b=6显酸性 不合题意 (2)3.5<a<![]()
22.(1)②③①
(2)②,①③为强酸,②为弱酸,当其pH相等时,溶液②的物质的量浓度最大,与Ba(OH)2溶液反应时,②过量但①③恰好完全反应,故溶液②反应后仍显酸性。
23.(1)![]() (2)
(2) ![]() ,
,![]() (3)BC
(3)BC
(4)![]()
![]()
24.现象: Ba2++CO32-=BaCO3↓,CO32-浓度减少,使平衡CO32-+H2O= HCO3-+OH-向逆反应方向移动,C(CO32-)减少趋近于10-7mol·L-1
25.(1) NaOH、Na2CO3 3∶1 33.6
(2)Na2CO3、NaHCO3 1∶1 112
(3)
解:图示表明,向溶液中滴加0.1mol/L的盐酸至不再放出CO2气体时,消耗盐酸的体积
为75mL。
所以原NaOH溶液的物质的量浓度为:
![]()