高三化学第一次调查研究考试
化学试题
说明:本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共110分.考试时间90分钟.
可能用到的相对原子质量:C 12 H 1 S 32 O16 Fe 56 Cu 64
第Ⅰ卷(选择题 共48分)
一、选择题(本题包括8小题,每小题6分,共48分.每小题只有一个选项符合题意)
1.下列说法正确的是( )
A.纳米材料是指一种称为“纳米”的新物质制成的材料
B.二氧化硅是生产光导纤维的主要原料
C.绿色食品是指不含任何化学物质的食品
D.酸性的雨水就是酸雨
2.国外试行用汽水(碳酸饮料)浇灌农田,它的作用是( )
①有利于植物呼吸
②改良碱性土壤,调节pH
③有利于土壤中![]() 、
、![]() 被植物吸收
被植物吸收
④加速光合作用
A.全部都正确 B.只有②④正确
C.只有①④正确 D.只有②③④正确
3.已知在25℃,101 kPa下,1 g ![]() (辛烷)燃烧生成二氧化碳和液态水时放出
(辛烷)燃烧生成二氧化碳和液态水时放出
48.40 kJ热量.表示上述反应的热化学方程式正确的是( )
A.![]() ;DH=+5518 kJ·
;DH=+5518 kJ·![]() ;
;
B.![]() ;DH=-48.40 kJ·
;DH=-48.40 kJ·![]()
C.![]() ;DH=-5518 kJ·
;DH=-5518 kJ·![]()
D.![]() ;DH=-48.40 kJ·
;DH=-48.40 kJ·![]()
4.常温下分别将下列各组中的两种溶液等体积混合,所得溶液的pH一定等于7的是( )
A.0.1 mol·![]() 的某一元酸和0.1 mol·
的某一元酸和0.1 mol·![]() 的某一元碱
的某一元碱
B.0.1 mol·![]() 的某二元强酸和0.1 mol·
的某二元强酸和0.1 mol·![]() 的某二元碱
的某二元碱
C.pH=2的某一元酸和pH=12的某一元碱
D.pH=3的某二元强酸和pH=11的某一元强碱
5.据报道,美国正在研究的锌电池可能取代目前广泛使用的铅酸蓄电池,它具有容量大等优点,其电池反应为![]() ,其原料为锌粒、电解液和空气,则下列叙述正确的是( )
,其原料为锌粒、电解液和空气,则下列叙述正确的是( )
A.电解液肯定是强酸
B.正极发生氧化反应
C.负极反应为![]()
D.锌为正极,空气进入负极反应
6.下列叙述中,正确的是( )
A.某物质只含一种元素,则该物质一定是纯净物
B.具有相同质子数的粒子一定属于同一种元素
C.任何原子都是由质子、中子和电子构成
D.有单质参加也有单质生成的反应,不一定是氧化还原反应
7.铁酸钠(![]() )是一种新型净水剂,制取铁酸钠的离子反应方程式为:
)是一种新型净水剂,制取铁酸钠的离子反应方程式为:
![]() ,该反应的离子方程式中
,该反应的离子方程式中![]() 的化学计量数是( )
的化学计量数是( )
A.4 B.6
C.10 D.8
8.可逆反应aA(g)+bB(g)![]() c(g)+dD(g);DH同时符合下列两图中各曲线的规律的是( )
c(g)+dD(g);DH同时符合下列两图中各曲线的规律的是( )
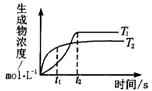
图1 图2
A.a+b>c+d ![]() <
<![]() DH<0
DH<0
B.a+b>c+d ![]() <
<![]() DH>0
DH>0
C.a+b<c+d ![]() >
>![]() DH<0
DH<0
D.a+b>c+d ![]() >
>![]() DH>0
DH>0
第Ⅱ卷(非选择题 共62分)
二、(本题包括5小题,共62分)
9.(10分)把铝放入过量的NaOH溶液中,发生反应的离子方程式为______________.若向反应后的溶液中通入足量的![]() 气体,出现的现象是________;若向反应后的溶液中滴加盐酸,看到的现象是________________.
气体,出现的现象是________;若向反应后的溶液中滴加盐酸,看到的现象是________________.
10.(10分)有A、B、C、D、E五种元素,原子序数E<C<D<A<B;E原子最外电子层有4个电子;![]() 离子和
离子和![]() 离子的核外电子层结构相同;D的气态氢化物的化学式为
离子的核外电子层结构相同;D的气态氢化物的化学式为![]() ,D在其最高价氧化物中的质量分数为40%,且D原子核内质子数和中子数相等;C的原子序数比D少5,比B少8.
,D在其最高价氧化物中的质量分数为40%,且D原子核内质子数和中子数相等;C的原子序数比D少5,比B少8.
(1)D元素位于第________周期________族.
(2)五种元素最高价氧化物的水化物中,酸性最强的是(写化学式).
(3)写出B元素的单质与水反应的离子方程式.
(4)写出C元素一种氧化物的电子式.
11.(8分)下图四个装置,各工作一段时间后,溶液pH显著升高的是________;溶液中电解质质量不变的是________.
12.(22分)![]() 是一种很重要的化学物质,某学生拟在实验室中制备.下面是他的实验过程.
是一种很重要的化学物质,某学生拟在实验室中制备.下面是他的实验过程.
用50 mL NaOH溶液吸收![]() 气体制备
气体制备![]() .为了防止通入的
.为了防止通入的![]() 过量而生成
过量而生成![]() ,他设计了如下步骤:(ⅰ)用25 mL NaOH溶液吸收过量的
,他设计了如下步骤:(ⅰ)用25 mL NaOH溶液吸收过量的![]() 气体,至
气体,至![]() 气体不再溶解;(ⅱ)小心煮沸溶液1~2 min(此时
气体不再溶解;(ⅱ)小心煮沸溶液1~2 min(此时![]() 不分解);(ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合.试回答:
不分解);(ⅲ)在得到的溶液中加入另一半(25 mL)NaOH溶液,使溶液充分混合.试回答:
(1)他能否制得较纯净的![]() ________(选填“能”或“不能”)请说出理由.
________(选填“能”或“不能”)请说出理由.
(2)按他的设计,第(i)步实验装置如下图:
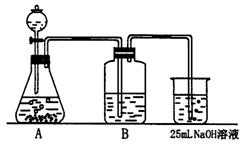
①装置A使用的试剂是石灰石和盐酸溶液,一般不用纯碱代替石灰石,原因是什么?
②装置B使用的试剂是________,作用是________________.
③为了后续的煮沸、混合等实验,装NaOH溶液的容器还可使用________(填仪器名称).
④有同学认为实验步骤(ⅱ)与(ⅲ)的顺序对调,即先混合,再煮沸,更合理,你认为对吗?________(选填“对”或“不对”).为什么?
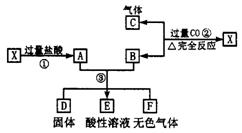
13.(12分)已知X为FeO和CuO的混合物,取两份等质量的X样品进行了①、②、③步实验,关系如下图(其中固体D不溶于稀盐酸):

(1)写出物质D的化学式:________.
(2)若所得固体D的质量为32 g,溶液E中只含一种金属离子,气体F在标准状况下体积为5.6 L,试计算X中FeO与CuO的质量比(写出计算过程).
参考答案
一、1.B 2.D 3.C 4.D 5.C 6.D 7.D 8.A
二、9.(10分)![]() (4分)有白色絮状沉淀生成(2分) 先有白色絮状沉淀生成(2分),随着盐酸的不断滴入生成的沉淀又溶解(2分)
(4分)有白色絮状沉淀生成(2分) 先有白色絮状沉淀生成(2分),随着盐酸的不断滴入生成的沉淀又溶解(2分)
10.(10分)(1)三 Ⅵ
(2)![]()
(3)![]()
(4)![]() (每空2分)
(每空2分)
11.(8分)④ ①③④(每填对1个给2分)
12.(22分)(1)能(2分) 步骤(i)中在生成![]() 时,过量溶解的
时,过量溶解的![]() 气体在步骤(ii)中煮沸时能除去;(2分)步骤(iii)中加入的NaOH恰好能使
气体在步骤(ii)中煮沸时能除去;(2分)步骤(iii)中加入的NaOH恰好能使![]() 完全转化为
完全转化为![]() .(2分)
.(2分)
(2)①纯碱是粉末,不易控制反应速率;(2分)不经济,纯碱比石灰石贵.(2分)
②饱和![]() 溶液.(2分)
溶液.(2分)
除去HCl气体(2分)
③锥形瓶(2分)
④不对,(2分)若不先驱走溶液中溶解的![]() 气体,步骤(iii)加入的NaOH将有部分与
气体,步骤(iii)加入的NaOH将有部分与![]() 反应被消耗掉,使
反应被消耗掉,使![]() 不能完全转化成
不能完全转化成![]() .(4分)
.(4分)
13.(12分)(1)Cu (2分)
(2)解:a.由![]()
知与盐酸反应的Fe的质量为:![]()
![]() =14g(2分)
=14g(2分)
b.依题意一份X中含Cu 32 g÷2=16 g(1分)
由 ![]() 差量
差量
64 56 8
16 g
得16 g ![]() 与Fe反应的差量为
与Fe反应的差量为![]() =2 g(2分)
=2 g(2分)
与16 g ![]() 反应的Fe的质量为
反应的Fe的质量为![]() =14 g(2分)
=14 g(2分)
所以一份X中含Fe的质量为14 g+14g=28 g(1分)
c.X中FeO与CuO的质量比为
![]() =9∶5(2分)
=9∶5(2分)
注:1.化学专用名词出现错别字,不得分.
2.书写的化学方程式未配平,扣一半的分.
3.考生的其他合理答案给相应分.