高三化学第一轮复习第二次月考
化学试题
本试卷分第I卷(选择题)和第II卷(非选择题)两部分,全卷满分150分。考试时间120分钟。
第I卷(选择题共74分)
注意事项:
1.回答I卷前,考生务必在答题卡和答题卷姓名栏内写上学校、姓名、考试科目、考试证号等,并用2B铅笔涂写在答题卡上。
2。每小题选出正确答案后,用2B铅笔把答题卡上对应题号的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案。不能答在试题卷上。
3.考试结束,将答题卡和答题卷一并交回。
可能用到的相对原子质量:H—1 C—12 O—16 Na—23 A1—27 Fe—56
一、选择题(本题包括8个小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.随着科技的飞速发展,出现了许多新型无机材料,如植入生物体内的生物陶瓷材料HAP[化学式为Cam(P04)n(OH)2],已被医疗上用于修补人的骨骼和牙组织,HAP的化学式中m等于
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
2.分析发现,某陨石中含有半衰期极短的镁的一种放射性同位素28Mg,该同位素的原子核内的中子数是
 A.12 B.14 C.16 D.18
A.12 B.14 C.16 D.18
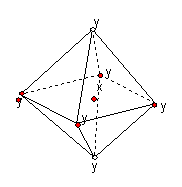
3.在某晶体中,与某一种微粒x距离最近且等距离的另一种微粒y
所围成的空间构型为正八面体型(如图)。该晶体可能为
A.NaCl B.CsCl C.CO2 D.SiO2
4.有关晶体的叙述中正确的是
A.在Si02晶体中,由Si、O构成的最小单元环每个平均占有8个原子
B.在12 g金刚石中,含C—C共价键键数为4NA
C.在含阳离子的化合物晶体中一定含阴离子
D.金属晶体是由金属原子直接构成的
5. 下列各组试剂在溶液中反应,当两种试剂的量发生改变时,不能用同一离子方程式表示的是
A.氯化镁、氢氧化钠 B.硫酸钠、氢氧化钡
C.氯化铝、氨水 D.溴化亚铁、氯水
6. 下列物质:①干冰,②石英,③白磷,④氯仿,⑤过氧化钠。其中含极性键的非极性分子是
A.②③⑤ B.仅②③ C.仅① D.①③④
7.下列对实验仪器名称的标注或实验操作,正确的是
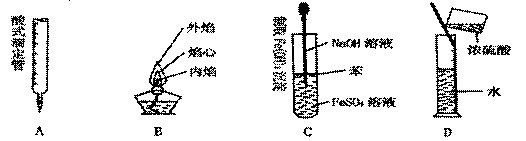 |
8.固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子电子层结构。则下列有关说法中错误的是
A.1molNH5中含有5NA个N—H键(NA表示阿伏加德罗常数的值)
B.NH5中既有共价键又有离子键,它形成的晶体是离子晶体
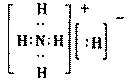 C.NH5的电子式为
C.NH5的电子式为
D.它与水反应的化学方程式为NH5+H2O==NH3·H2O+H2↑
二、选择题(本题包括10小题,第9-16题每小题4分,第17、18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.下列离子方程式书写正确的是
![]() A.碳酸钠溶液显碱性:CO32- + 2H2O
H2CO3
+2OH-
A.碳酸钠溶液显碱性:CO32- + 2H2O
H2CO3
+2OH-
B.氯化铝溶液中加入偏铝酸钠溶液:Al3+ +3AlO2- +6H2O= 4Al(OH)3 ↓
C.氨气通入碳酸氢钠溶液中:NH3 +H+ = NH4+
D.碳酸氢钙溶液中加入过量的氢氧化钠溶液:
Ca2+ +2HCO3- +2OH-= CaCO3↓+2 H2O+CO32-
10. 下列各组离子中,一定能大量共存的是
A.加入铝粉有氢气产生的溶液中:Na+、SO42-、C1-、K+
B.pH = 0的无色溶液中:Na+、K+、MnO4-、NO3-
C.在0.1mol/L的醋酸溶液中:Fe2+、Na+、ClO-、Ca2+
D.某无色中性溶液中:Cl-、SO42-、Na+、Ca2+
11.下列两种气体的分子数一定相等的是 ( )
A.质量相等、密度不等的N2和C2H4 B.等体积等密度的CO和C2H4
C.等温等体积的O2和N2 D.等压等体积的N2和CO2
12.氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3 C 高温 2 AlN + 3 CO 下列叙述正确的是
A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中每生成2 mol AlN,N2得到3 mol电子
C.氮化铝中氮元素的化合价为—3
D.氮化铝晶体属于分子晶体
13.核能是能量的重要来源,用少量的核燃料可以获得十分巨大的能量,lmol天然气中的甲烷完全燃烧时,放出882.8kJ的热,而lmol锂核跟lmol氢核生成2mol氦核的核聚变反应,放出的热量高达9.6×108KJ。有关锂原子和锂的化合物的说法错误的是
A.质量数为7的锂原子核内中子数是4
B.锂原子的半径比钠原子的半径小
C.锂与钠、钾不同,锂保存在石蜡中
D.氢氧化锂的碱性比氢氧化钠强
14.向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL l moL/L的盐酸;恰好使混合物完全溶解并放出标准状况下224mL气体。向所得溶液中加入KSCN溶液无血红色出现,若用足量的CO在高温下还原相同质量的此混合物,能得到单质铁的质量为
A.11.2g B.2.8g C.5.6g D.无法计算
15.燃料电池是利用燃料(如H2、CO、CH4等)跟氧气或空气反应,将化学能转化成电能的装置,电解质是强碱溶液。下面关于甲烷燃料电池的说法正确的是
A.负极反应为O2+2H2O+4e==4OH--
B.负极反应为CH4+10OH——8e==CO32—+7H2O
C.放电时溶液中的阴离子向负极移动;
D.随放电的进行,溶液的pH不变。
16. 常温下,下列各组物质不能用一种试剂通过化学反应区别的是
A.MnO2 CuO FeO
B.Na2CO3 NaHCO3 K2CO3
C. AgNO3 KNO3 Na2CO3
D.(NH4)2SO4 K2SO4 NH4Cl
17. 用6.02×1023表示阿伏加德罗常数的值,下列说法中正确的是
A.在SiO2晶体中,若含有1mol Si原子,则Si-O键数为4NA
B.6.8 g熔融的KHSO4中含有6.02×1022个阳离子
C.23.4 g NaCl晶体中含有6.02×1022个下图所示的结构单元
D.用含有0.1molFeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1N
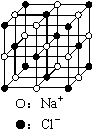 |
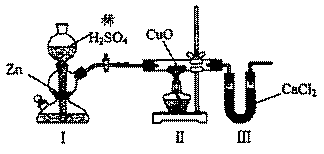 18.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
18.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8。下列对导致这一结果的原因的分析中,一定错误的是
A.I、Ⅱ装置之间缺少干燥装置
B.CuO没有全部被还原
C.Ⅱ装置中玻璃管内有水冷凝
D.Ⅲ装置后缺少干燥装置
第Ⅱ卷(非选择题 共76分)
三、(本题包括2小题,共16分)
|
|
![]() a.H2,b.Cl2,c.CH4,d.HCl,
e.NH3,f.NO,
g.H2S,h.SO2
a.H2,b.Cl2,c.CH4,d.HCl,
e.NH3,f.NO,
g.H2S,h.SO2
(1)若试管是干燥的,则由B口进气可收集的气体有
(写序号下同)。
(2)若试管充满水,可收集的气体有 ,这时气体由 口进入。
(3)若试管是干燥的,则A口进气,可收集的气体有 。
(4)若在试管内装入浓硫酸进行气体干燥,则可用此装置来干燥的气体有 ,这时气体由 口进入。
20.(8分)人们对酸碱的认识,已有几百年的历史,经历了一个由浅入深、由低级到高级的认识过程。我们目前中学课本中的酸碱理论是1887年阿仑尼乌斯(Arrhenius)提出了的电离理论。
(1)1905年富兰克林(Franklin)深入研究了水和液氨的相似性,把阿仑尼乌斯以水为溶剂的个别现象,推到任何溶剂,提出了酸碱溶剂理论。溶剂理论认为:凡能离解而产生溶剂正离子的物质为酸,凡能离解而产生溶剂负离子的物质为碱。试写出液氨自身弱电离的方程式: 。
(2)1923年丹麦化学家布朗斯物(Brφusted)和英国化学家劳莱(Lowry)提出了质子论。凡是能够释放质子(氢离子)的任何含氢原子的分子或离子都是酸;凡是能与质子(氢离子)结合的分子或离子都是碱。
按质子理论:下列粒子在水溶液既可看作酸又可看作碱的是 。
A.H2O B.NH4+ C.OH- D.HCO3- E.CH3COO- F.Cl-
(3)1923年路易斯(Lewis)提出了广义的酸碱概念。凡是能给出电子对而用来形成化学键的物质是碱;凡是能和电子对结合的物质都是酸。如:
酸(电子对接受体) 碱(电子对给予体) 反应产物
H+
+
[∶OH ]— ![]() H∶OH
H∶OH
试指出下列两个反应中的酸或碱
① H3BO3 + H2O= H+ + B(OH)4- 该反应中的碱是 (填:H3BO3 或 H2O)
②NaH + H2O = NaOH +H2↑ 该反应中的酸是 (填:NaH 或 H2O)
四、(本题包括2小题,共21分)
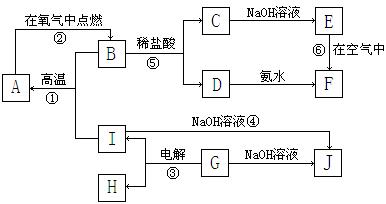 |
21.(11分)A~I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
⑴A、B、C、D、E、F六种物质中所含同一种元素在周期表中位置___________________。
⑵写出C、G物质的化学式。
C____________________ G______________________
⑶写出①、④、⑥反应的化学方程式。
反应①:___________________________________________________________
反应④:___________________________________________________________
反应⑥:___________________________________________________________
⑷从能量变化的角度看,①②③反应中属于△H<0的反应是___________。(填序号)
22.(10分)下表是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素。
|
|
| ||||||
|
|
|
| |||||
|
|
|
|
(1)上述元素的单质中熔点最高的可能是______(填字母)。
(2)![]() 和
和![]() 的化学性质相似,其原因是_____________________________________________________的缘故。
的化学性质相似,其原因是_____________________________________________________的缘故。
(3)“神舟”五号飞船内需要有一种化合物来吸收航天员呼出的![]() ,你认为该物质应该是由上表中的______(填字母)元素组成的。飞船中需要制造一种适合航天员生存的人工态环境,应该在氧气中充入一种稀释气体,该气体分子式为________。
,你认为该物质应该是由上表中的______(填字母)元素组成的。飞船中需要制造一种适合航天员生存的人工态环境,应该在氧气中充入一种稀释气体,该气体分子式为________。
(4)在一定条件下,![]() 与
与![]() 可形成一种化合物,其晶体类型为_______;该物质溶于水后的溶液呈_____性(填“酸”、“碱”或“中”)。
可形成一种化合物,其晶体类型为_______;该物质溶于水后的溶液呈_____性(填“酸”、“碱”或“中”)。
(5)现有另一种元素,其原子获得一个电子所释放出能量是上表中所列元素中最大的,则X是周期表中_____族元素。
五.(本题包括2小题,共22分)
23.(10分)有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A 和B原子有相同的电子层数, 且A的最外层电子数是次外层电子数的两倍; C燃烧时呈现黄色火焰, C的单质在加热条件下与B的单质反应, 可以得到与D单质颜色相同的固态化合物;D的最高价与最低价代数和为其最低价绝对值的两倍,试根据以上叙述回答:
(1)写出A与B两元素所形成化合物的结构式为 ______________;(2分)
该化合物分子所含有的化学键属于(极性键或非极性键)______________;(1分)该化合物分子属于(极性分子或非极性分子)______________;(1分)
(2)用电子式表示C与B两元素可能形成的化合物______ _____ ;(2分)
(3)画出D的原子结构示意图 ___________________,(2分)
用电子式表示C与D两元素构成的化合物的形成过程
_______________________________________________。(2分)
24.(12分) 磷在氧气中燃烧,可能生成两种固态氧化物。3.1g的单质磷(P)在3.2g的氧气中燃烧,至反应物耗尽,并放出X KJ热量。
⑴ 通过计算确定反应产物的组成(用化学式表示)是____________________,其相应的 质量(g)为________________。
⑵ 已知单质磷的燃烧热为Y KJ/mol,则1mol P与O2反应生成固态P2O5 的反应热
△H = ________________。
⑶ 写出1mol P与O2反应生成固态P2O3 的热化学反应方程式:
__________________________________________。
六、(本题包括2小题,共17分)
25.(8分)将标准状况下的11.2L氨气溶于100mL水中,得到密度为0.868g·cm-3氨水。
(1)求所得氨水的物质的量浓度?
(2)取上述氨水30.0mL与70.0ml 2.00mol·L-1的AlCl3溶液相混合,产生的白色沉淀的质量是多少?
(3)往上述反应后未过滤的溶液中加入一定体积的5mol·L-1的NaOH溶液后,混合后体系中沉淀的质量与上述(2)中产生的沉淀质量相等,求加入的NaOH溶液的体积是多少?
26.(9分)将Na2O2和NaHCO3固体混合物置于密闭容器中加充分反应,放出气体后冷却。加热时可能发生的反应如下:
2 Na2O2+2NaHCO3![]() 2NaOH+2Na2CO3+O2↑
2NaOH+2Na2CO3+O2↑
2 Na2O2+4NaHCO3![]() 4Na2CO3+O2↑+2H2O
4Na2CO3+O2↑+2H2O
2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)若固体混合物的质量为m,反应后冷却再称其质量减少了△m。设NaHCO3、Na2O2的物质的量分别为a,b,试确定下列条件下△m的取值范围(用含m的代数式表示)。
①当a/b≤1时,△m取值范围是
②当1<a/b≤2时,△m取值范围是
③当a/b>2时,△m取值范围是
(2)若m=14.52g,△m=1.28g时,向反应后的残留固体内滴加2.00mol/L盐酸140.0mL,可产生标准状况下的气体 L。
高三第一轮复习第二次月考
化学试题参考答案
第Ⅰ卷
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 答案 | A | C | A | C | D | C | C | A | BD |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | A | AB | C | CD | B | BC | B | AC | B |
19. (8分)(1) a c e (2) a c f B (3) bdh (4) abcdfh A
20. (8分,每空2分)(1)2NH3 ![]() NH4+ + NH2-
NH4+ + NH2-
(2)AD (3)H2O;H2O
21.⑴第四周期、第Ⅷ族 ⑵FeCl2 Al2O3 ⑶8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
2Al+2 Na OH+2H2O=2 Na AlO2+3H2↑ 4Fe(OH)2+O2+2H2O=4Fe(OH)3
⑷①② (前3空每空1分,其他每空2分,共11分)
22.(10分)
(1)d (1分)
(2) d、g元素性质随核电荷数递增而呈周期性的变化 (2分)
(3)c、f(1分) N 2 (1分)
(4)分子 (1分) 碱 (1分)
(5)ⅦA (1分)
23.(共8分)
(1)O=C=O; (1分) 极性键; 非极性分子(各1分)
![]() .(2) Na2O和Na2O2的电子式;(各1分)
.(2) Na2O和Na2O2的电子式;(各1分)
![]()
![]() (3)
(3)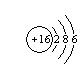 (1分)
(1分)
Na2S形成过程电子式表示(2分)
24.⑴ P2O3 P2O5
2.75 3.55
⑵ -(20X-Y) KJ/mol
⑶ P(s) + 3/4O2(g) == 1/2 P2O3(s);△H = -(20X-Y) KJ/mol
