高三化学第一学期期中考试试卷3
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。共150分。考试时间120分钟。
注意事项:
答题前,考生务必将自己的姓名、班级、学号写在答题纸的密封线内。选择题答案按要求填在答题纸上,非选择题的答案写在答题纸上对应题目的答案空格内,答案不写在试卷上。考试结束后,将答题纸交回。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32
C1 35.5 Ca 40 Fe 56 Cu 64
第Ⅰ卷 (选择题共72分)
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意)
1.CCTV《科技博览》报道,2004年3月中科院首创用CO2合成可降解塑料聚二氧化碳。下列相关说法合理的是
A.聚二氧化碳塑料是通过加聚反应制得的
B.聚二氧化碳塑料与干冰互为同素异形体
C.聚二氧化碳塑料与干冰都属于纯净物
D.聚二氧化碳塑料的使用会产生白色污染
2.下列各项中表达正确的是
A.F—的结构示意图:![]() B.CO2的分子模型示意图:
B.CO2的分子模型示意图:![]()
C.NaCl的电子式:![]() D.N2的结构式: :N≡N:
D.N2的结构式: :N≡N:
3.工业由粗硅制取纯硅有以下反应:
①Si(s)+3HCl(g) ![]() SiHCl3(g)+H2(g);△H=--318kJ·mol—l
SiHCl3(g)+H2(g);△H=--318kJ·mol—l
②SiHCl3(g)+ H2(g) ![]() Si(s) +3HCl(g);
Si(s) +3HCl(g);
下列关于上述反应的说法中不正确的是
A.反应①、②均为氧化还原反应 B.反应①、②均为置换反应
C.若反应①放热,则反应②一定吸热 D.欲提高SiHCl3产率,可减压或升温
4.在含有Cu(NO3)2、Mg(NO3)2和AgNO3的溶液中加入适量锌粉,首先置换出的是
A.Mg B. Cu C. Ag D. H2
5.据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A.N4是N2的同素异形体 B.N4是N2的同分异构体
C.相同质量的N4和N2所含原子个数比为1:2 D.N4的摩尔质量是56g
6.我国“神舟6号”宇宙飞船的运载火箭的推进剂引燃后发生剧烈反应,产生大量高温气体从火箭尾部喷出。引燃后的高温气体成分有CO2、H2O、N2、NO等,这些气体均为无色,但在卫星发射现场看到火箭喷射出大量红烟,产生红烟的原因是
A. 高温下N2遇空气生成NO2 B. NO遇空气生成NO2
C.CO2与NO反应生成NO2 D. NO与H2O反应生成NO2
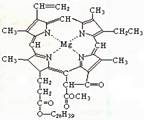 7.我国科学工作者合成了许多结构复杂的天然有机化合物,如:叶绿素、血红素、维生素B等,叶绿素的结构如右图所示,下列有关说法正确的是
7.我国科学工作者合成了许多结构复杂的天然有机化合物,如:叶绿素、血红素、维生素B等,叶绿素的结构如右图所示,下列有关说法正确的是
A.叶绿素属于高分子化合物
B.叶绿素分子中含有两种类型的双键
C.叶绿素不属于芳香烃
D.在一定条件下,叶绿素能加成、水解、酯化等反应
8.下图表示可逆反应mA(g)+nB(g) ![]() pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
pC(g)在不同温度(T)、压强(P)下,生成物C的物质的量分数x(C)的变化情况。下列关于该正反应热效应及方程式中A、B、C的化学计量数的判断中,正确的是
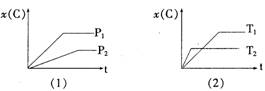 A.吸热反应,m+n<p
A.吸热反应,m+n<p
B.吸热反应,m+n>p
C.放热反应,m+n<p
D.放热反应,m+n>p
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9.对盐类物质可有下列分类:如氯化硝酸钙[Ca(NO3)Cl]是一种混盐,硫酸铝钾KAl(SO4)2是一种复盐,冰晶石(六氟合铝酸钠)Na3AlF6是一种络盐。对于组成为CaOCl2的盐可归类于
A.混盐 B.复盐 C.络盐 D.无法归属于上述类别
10.2004年诺贝尔化学奖授予美国和以色列的三位科学家,以表彰他们在蛋白质降解研究中所作出的贡献。下列关于蛋白质的叙述中,不正确的是
A.蛋白质属于天然有机高分子化合物,没有蛋白质就没有生命
B.某些蛋白质与浓硝酸作用会变黄
C.重金属盐溶液或硫酸铵溶液均能使蛋白质变性
D.利用丁达尔效应可区别蛋白质溶液和食盐水
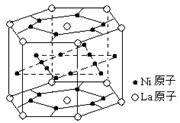 11.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
11.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
A.LaNi6 B. LaNi3
C.LaNi4 D. LaNi5
12.下列实验方案合理的是
A.用饱和碳酸钠溶液除去乙酸乙酯中混有的乙酸等杂质
B.用加入浓溴水的方法分离苯和苯酚的混合物
C.制备FeCl3溶液时,先将固体溶于较浓盐酸,再加水稀释
D.用润湿的pH试纸测量某酸溶液的pH
13.下列反应生成物不受反应物的用量或浓度影响的是
A.硫酸与磷酸钙反应 B.硝酸银溶液中滴加稀氨水
C.铁在硫蒸气中燃烧 D.铁粉加入硝酸中
14.设NA表示阿伏加德罗常数,下列叙述中正确的是
A.1mol金刚石晶体中含碳碳键数为2 NA
B.常温常压下,22.4L的D2、H2组成的气体分子数约为NA
C.标准状况下,22.4LSO3中含有的氧原子数约为3 NA
D.1molNa2O2与足量CO2反应转移的电子数NA
15.在由水电离产生的c(H+)=10-12mol·L-1的溶液中,一定能大量共存的离子组是
A.NH4+、Ba2+、Cl-、NO3- B.Cl-、SO42-、Na+、K+
C.SO42-、NO3-、Fe2+、Mg2+ D.Na+、K+、ClO-、I-
16.下列反应的离子方程式不正确的是
A.溴化亚铁溶液中通入过量氯气.2Fe2++2Br—+2C12==2Fe3++Br2+4C1—
B.草酸和少量烧碱溶液:H2C2O4+OH—==HC2O4—+H2O
C. 漂白粉溶液吸收过量的二氧化碳:ClO—十H2O+CO2==HClO+HCO3—
D.向NH4HSO4稀溶液中逐滴加入Ba(OH)2溶液至刚好沉淀完全
NH4++H++SO42-+Ba2++2OH-=NH3·H2O+BaSO4↓+H2O
17.在一密闭容器中,反应
aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度变为原来的60%,则
A.平衡向正反应方向移动了
B.平衡向逆反应方向移动了
C.物质B的质量分数增加了
D.a<b
18.镁铝合金5.1 g溶于300mL2mol/L的HCl,在标准状况下放出气体的体积为5.6L。向反应后的溶液中加入足量氨水,产生沉淀的质量为
A.5.1g B.10.2g C.13.6g D.15.3g
第Ⅱ卷 (非选择题共78分)
三、(本题包括2小题,共24分)
19.(1)(5分)2004年7月30日,位于秦皇岛海港区涂庄的一化学试剂厂,发生氯气泄漏事故,泄漏出的氯气迅速向周围的居民区蔓延,所到之处草木枯黄、大片蔬菜被毁。请回答下列问题:
①如果你当时在现场,你应该往哪里撤离?(山坡上/低洼处)
②如果你在该厂实验室准备撤离时,应该准备什么样的简易“防毒面具”避免吸入较多的氯气?
③如果你当时在距离化工厂较近的居民家中,如何利用家中现成物质来制作简易“防毒面具”?
④消防官兵赶到现场处理,他们先把泄漏的氯气钢瓶投入一盛有某物质水溶液的水缸中,该物质是
⑤对于弥漫在空气中没有散去的氯气,消防队员喷洒了一种挥发性化学物质水溶液进行处理,该化学物质是
(2)(6分)被称为“魔棒”的荧光棒已成为节日之夜青少年的喜爱之物,其发光原理是利用过氧化氢氧化草酸酯产生能量,该能量被传递给荧光物质后便发出荧光.回答下列问题:
①有人说,发光的魔棒不能凑近石油气之类的可燃性气体,否则会导致爆炸,是否正确?说明理由。
②通过挤压,使过氧化氢与草酸酯混合反应,导致魔棒发光,一段时间后,光的亮度降低,此时,把魔棒往手心上敲打几下,亮度会重新增大,原因是什么?(提示:草酸酯是一种有较高粘度的有机化合物)
③在设计魔棒时,其连续发光的能力在8-12h,如果在发光中途,把它放入冰箱的冷冻室中,发光便会停止或基本停止.把魔棒从冷冻室中取出静止一会儿,它又会连续发光,原因是什么?
20.(13分)我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献。他利用NaHCO3、NaCl、NH4C1等物质溶解度的差异,以食盐、氨气、二氧化碳等为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中模拟“侯氏制碱法”制取NaHCO3的实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4C1晶体析出。……
请回答下列问题:
(1)装置的连接顺序是:(a)接( ) ( )接( ); (b)接( )
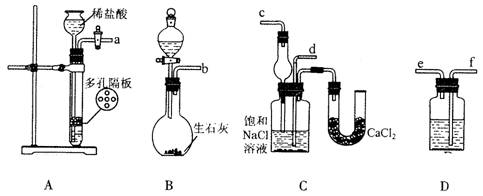
(2)A中常选用的固体反应物为 ;D中应选用的液体为 ;B中发生反应的化学方程式为 。
(3)第二步骤中必须先让 装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是 ,C中广口瓶内产生固体的总化学方程式为 。
(5)第四步中分离出NH4C1晶体的操作是 ;其所得的NH4C1晶体中常含有少量的NaCl和NaHCO3约占5%~8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:
。
四、(本题共10分)
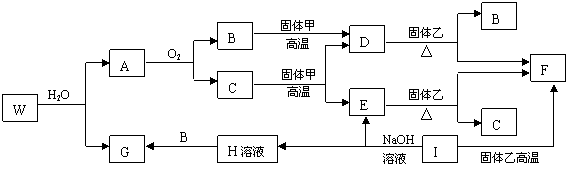 21.(10分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
21.(10分)已知固体甲、E、I、F均为常见的单质,其中E在常温下为气态。G为白色胶状沉淀,既能溶解于盐酸,又能溶解于氢氧化钠溶液。A在常温下为气态,与氧气完全反应时的体积比是1:2。W是由三种处在不同短周期的元素组成的化合物,与水反应生成A和G时的化学计量数之比为1:3:3:1。各物质有如下图所示的转化关系(部分反应的产物未全部表示)。试回答下列问题:
| | ||||
(1)B的电子式为 ,固体乙的化学式可能是 ;
(2)上述转化中,①C→E ②D→F ③E→F ④I→F ⑤I→E ⑥A→B 其中属于置换反应的是(填序号) ;
(3)写出W和水反应的化学方程式____________________________________________,
I和NaOH溶液反应的离子方程式________________________________________。
五、(本题包括3小题,共28分)
22.(6分)实验测得某烃中碳元素的质量分数为91.3%,相对分子质量为92,则该烃的分子式为____________。若该烃为芳香烃,在其分子的“C-C”键或“H-C”键中
![]()
插入基团“ ”可形成六种含苯环的酯,请写出其中四种酯的结构简式:
__________________________________、____________________________________、
__________________________________、____________________________________。
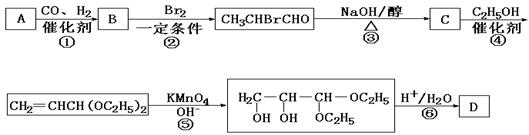
23.(12分)化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)。
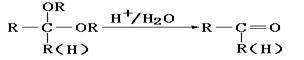
已知:
请回答下列问题:
(1)写出下列物质的结构简式:
A:__________;B:____________;C:_____________;D:___________。
(2)指出反应②的反应类型______________________。
(3)写出反应③的化学方程式___________________________________________。
(4)反应④的目的是___________________________________________________。
(5)化合物D’是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D’在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4)。请分别写出D’生成E和F的化学方程式:
D’→E:___________________________________________________________。
D’→F:___________________________________________________________。
24.(10分)软性隐形眼镜可由聚甲基丙烯酸羟乙酯(HEMA)制成超薄镜片,其合成路线可以是:
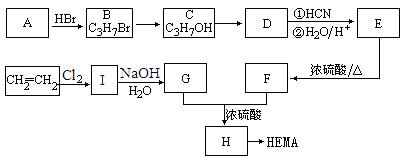
已知⑴![]()
⑵CH3COOCH2CH2OH的名称为乙酸羟乙酯
试写出:
⑴A、E的结构简式分别为:A 、E 。
⑵写出下列反应的反应类型:C→D ,E→F 。
⑶写出下列转化的化学方程式:I→G ;
G+F→H 。
六、(本题包括2小题,共16分)
25.(8分)将Cu与Fe2O3的混合粉末a g与1mol/L硫酸进行反应。
(1)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中无Fe3+,则
a= ,混合粉末中铜的质量为 。
(2)若将固体完全溶解于1.00L上述硫酸中,测得c(Fe3+)=0.1mol/L(假设反应前后溶液的体积不变),则混合粉末中铜的质量的最大值为 g。
(3)若固体恰好完全溶解,消耗硫酸的体积为0.3L,且所得溶液中既有Fe3+,也有Fe2+,则 a 的取值范围是 。
26.(8分)在t℃时,向盛有500 g水的烧杯中加入7.77 g Ca(OH)2粉末,充分搅拌。已知t℃时,Ca(OH)2的溶解度是0.185 g。并假设在溶解和反应过程中溶液的体积温度基本保持不变,所得溶液的密度约为1.00g/cm3。试计算下列问题。
(1)求烧杯中所得的石灰水中OH—离子的物质的量浓度。
(2)若采用向上述烧杯中通入CO2气体的方法,使溶液中的Ca2+离子浓度等于0.010 mol·L—1,则需要向烧杯中通入标准状况下CO2 的体积是多少?
高三化学期中试卷参考答案
第工卷 (选择题,每小题4分,共72分)
一、1.A 2.A 3.D 4.C 5.A 6.B 7.C 8.D
二、9.A 10. C 11.D 12.AC 13.C 14.A D 15.B 16.A 17.B 18.C
第Ⅱ卷 (共76分)
三、(本题包括2小题,共24分)
19.(1)(各1分,共5分)①山坡上;
②碳酸钠溶液或碳酸氢钠溶液浸湿毛巾;
③肥皂水(或洗衣粉)浸湿毛巾;
④氢氧化钠溶液或者氢氧化钙溶液;
⑤浓氨水。
(2)(6分)①不正确.因为是“冷光”而不是明火。(2分)
②由于粘度大,反应物不易充分混合,敲打是促进混合,从而促进反应。(2分)
③低温使氧化反应变得十分缓慢,恢复常温时反应又加速进行。(2分)
20.(13分)(1)f e d c(2分)
(2)块状石灰石 饱和NaHCO3溶液 CaO+NH3·H2O=Ca(OH)2+NH3↑(其他合理答案均给分)(4分)
(3)B (1分)
(4)防倒吸 CO2+NH3+NaCl+H2O=NaHCO3↓+NH4Cl (3分)
(5)过滤 取少量固体放入试管中,加热,固体大部分消失,在试管口又有较多的固体凝结(其他合理答案均给分)(3分)
四、21.(每小题各2分,共10分)
![]() (1) Fe2O3
(2) ①③④
(1) Fe2O3
(2) ①③④
(3) Al(CH3)3 + 3H2O = 3CH4 ↑+ Al(OH)3 ↓ 2Al + 2OH- + 2H2O = 2AlO2- + 3H2 ↑
五、(本题包括3小题,共28分)
22、(6分)C7H8(2分)
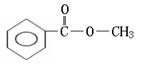
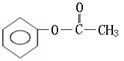
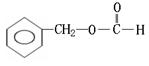
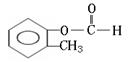 (邻、间、对)
(邻、间、对)
[以上六种任选四种](各1分)
23、(12分)(1)A:CH2=CH2 B:CH3CH2CHO
C:CH2=CHCHO D:CH2(OH)CH(OH)CHO(各1分)
(2)取代(1分)
(3)CH3CHBrCHO+NaOH→CH2=CHCHO+NaBr+H2O[条件:醇/△] (2分)
(4)保护醛基,防止反应⑤时被高锰酸钾碱性溶液氧化(1分)
(5)
D’→E:CH3CH(OH)COOH→CH2=CHCOOH+H2O[条件:浓硫酸 /△](2分)
D’→F:
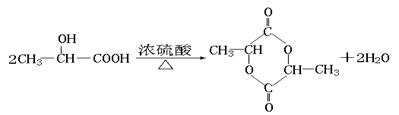 (2分)
(2分)
24.(10分)⑴CH2=CHCH3 (CH3)2C(OH)COOH (各2分)
⑵氧化 消去 (各1分)
⑶CH2ClCH2Cl+2H2O![]() HOCH2CH2OH+2HCl
(各2分)
HOCH2CH2OH+2HCl
(各2分)
HOCH2CH2OH +CH2=C(CH3)COOH
![]() CH2=C(CH3)COOCH2CH2OH+H2O
CH2=C(CH3)COOCH2CH2OH+H2O
六、(本题包括2小题,共16分)
25.(8分)(1) 22.4(2分) 6.4g (2分)
(2)18.1(2分)
(3) 16<a<22.4 (2分)
26.解:⑴因为
![]() 所以Ca(OH)2没有完全溶解。
(2分)
所以Ca(OH)2没有完全溶解。
(2分)
(2分)
(2)7.77g ÷74g·mol—1=0.105 mol
0.010 mol·L—1×0.5L=0.005 mol (1分)
①当溶液中Ca2+由Ca(OH)2提供时,根据方程式Ca(OH)2+CO2=CaCO3↓+H2O可知:
与CO2反应的Ca(OH)2的物质的量为
0.105 mol-0.005 mol=0.100 mol
需要通入标准状况下二氧化碳气体为0.100 mol×22.4L·mol—1=2.24L (1分)
②当溶液中Ca2+由Ca(HCO3)2提供时,根据方程式Ca(OH)2+CO2=CaCO3↓+H2O,
CaCO3+CO2+H2O= Ca(HCO3)2
消耗CO2的物质的量为
0.105 mol﹢0.005 mol=0.110 mol (1分)
需要通入标准状况下二氧化碳气体为0.110 mol×22.4L·mol—1=2.464L (1分)