专题 高三化学电化学(续)
江苏省兴化楚水实验学校 宗 汉
.【例1】目前世界上采用的合成氨技术是德国人哈伯在1905年发明的。2001年有两位希腊化学家在美国《科学》杂志上发表文章,在常压下把氢气和用氨稀释的氮气分别通入一个加热到570℃的电解池(如图),氢气和氮气在电极上可合成氨,而且转化率高达78%!(图中涂黑处表示新法合成氨中所用的电解质,它能传导H+)。下列说法不正确的是 (b)
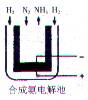 A、新法合成氨的电解池中可以用水溶液作电解质
A、新法合成氨的电解池中可以用水溶液作电解质
B、新法合成氨的电解池中不能用水溶液作电解质
C、新法合成氨的阳极反应为:3H2—6e-==6H+
![]() D、新法合成氨的电解反应为:N2+3H2 2NH3
D、新法合成氨的电解反应为:N2+3H2 2NH3
【例2】.有两只串联的电解池(惰性电极),甲池盛有CuSO4溶液,乙池盛有一定量某硝酸盐的稀溶液。电解时当甲池电极析出1.6gCu时,乙池电极析出0.54g金属,则乙池的溶质可能是 ( a.b )
A.AgNO3 B.Cu(NO3)2 C.Mg(NO3)2 D.Al(NO3)3
【例3】分别以新配制的NaOH、H2SO4溶液作电解质溶液进行电解,在阴极得H2,阳极得O2,按说这两种气体的体积比应为2:1,然而实验结果(见下表)却不是2:1
| 电解时间 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| NaOH | 阴极生成气体 | 6 | 12 | 20 | 29 | 39 | 49 | 55 | 65 | 75 | 85 |
| 阳极生成气体 | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 | |
| H2SO4 | 阴极生成气体 | 6 | 12 | 20 | 27 | 34 | 42 | 50 | 58 | 66 | 74 |
| 阳极生成气体 | 1 | 2 | 4 | 7 | 10 | 13 | 16 | 19 | 22 | 25 | |
(1)NaOH溶液为电解质溶液,自7分钟后的每分钟内生成的两种气体体积比为2:1,为什么?
(2)H2SO4溶液为电解质溶液,在电解过程中生成的两种气体体积比均不是2:1,为什么?
答案:电解NaOH溶液,开始6分钟内,因产物H2、O2溶解度不同(后者溶解度大),致使气体体积比小于2:1.此后,因H2、O2溶解已到饱和,气体产物体积比保持2:1.
电解H2SO4溶液,因H2、O2溶解度不同及阳极发生副反应(生成O3,S2O2-8),致使气体体积比小于2:1.
【例4】 . (1986年全国青年化学竞赛试题) 电解法处理含Cr(Ⅵ)废水(pH=4~6,含Cr(Ⅵ) 25~150mg/L)的一种方法是:往废水里加入适量NaCl(1~2g/L),以铁为电极进行电解,同时鼓人空气,经过一段时间后,废水中含Cr量降到可排放的标准.
①加适量NaCl是为了 ;鼓人空气目的是在于 ;
②除Cr过程中发生的主要反应方程式为:
Ⅰ.电极反应: ,
Ⅱ.溶液中的反应 、
、 .
答案:①增大电导;起搅拌作用.
②ⅠFe-2e-=Fe2+; 2H++2e-=H2
或2H2O+2e-=H2+2OH-
Ⅱ Cr(Ⅵ)+3Fe(Ⅱ)=Cr(Ⅲ)+3Fe(Ⅲ)
Fe(Ⅲ)+3OH-=Pe(OH)3↓
Cr(Ⅲ)+3OH-=Cr(OH)3↓
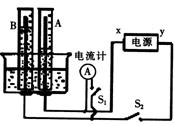
【例5】(2000河南)如图所示的实验装置中,x、y分别
为直流电源的两极.向A、B中充满KOH溶液后倒立于
盛有KOH溶液的水槽中,再分别插一多孔的惰性电极.
切断电源开关S1,闭合开关S2,通电一段时间后A、B中
生成的气体的体积见下表:
| 电解时间/min | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A气体的体积/cm3 | 6 | 12 | 20 | 29 | 39 | 49 | 55 | 65 | 75 | 85 |
| B气体的体积/cm3 | 2 | 4 | 7 | 11 | 16 | 21 | 26 | 31 | 36 | 41 |
(1)标出电源正、负极:x为 极,y为 极.
(2)写出A、B电极反应式:A中 ,B中 .
(3)7分钟后,每分钟内A、B中气体体积的增加量之比为2:1,而在此之前,A、B中生成气体的体积之比
2:1(填“大小’’或“小于”或“等于”),请说明这其中可能的原因:
.
(4)电解10分钟后,A、B中均有气体包围电极.此时切断S2,闭合开关Sl,发现电流计的指针发生偏转.请用有关电极反应式,说明电流计偏转的原因:
A中 , B中 .
答案:(1)负、正
(2)A:4H++4e-=2H2↑ B:4OH--4e-=2H2O+O2↑
(3)大于;O2在KOH溶液中的溶解度大于H2在KOH溶液中的溶解度,7分钟后溶液达饱和.
(4)A:2H2-4e-=4H+ B:O2+2H2O+4e-=4OH-
【例6】工业上为了处理含有重铬酸根离子(Cr2O2-7)的酸性废水,采用如下方法:往工业废水中加入适量的食盐,以铁为电极通直流电进行电解.鼓人空气,经过一段时间,水中有Cr(OH)3,和Fe(OH)3沉淀生成,使废水达到可排放的标准.
回答下列问题:
(1)加入适量食盐的作用是 .
(2)写出电极的反应:阳极 ,阴极 .
(3)写出有关反应的离子方程式:
①Cr2O2-7变为Cr3+ ;
②Cr3+变为Cr(OH)3 .
③生成Fe(OH)3 .
(4)根据(3)中的反应,解释形成Cr(OH)3和Fe(OH)3沉淀的原因: .
(5)能否用石墨电极代替铁电极达到电解除去废水中污染物Cr2O2-7离子的目的 ,理由是 .
分析开始通电时,向阳极迁移的离子有:Cl-、Cr2O2-7、H2O中OH-; 铁做电极,阳极一定是铁放电生成Fe2+:Fe-2e-=Fe2+,故NaCl中Cl-不参加电极反应.
向阴极迁移的离子有:Na+、H+;放电能力H+>Na+,故NaCl中Na+不参加电极反应,食盐的作用是增强废水的导电性,加快除去污染物的反应速率.在酸性溶液中阴极的反应为:2H++2e-=H2↑.
在阳极区溶液中,Cr2O2-7的强氧化性能将电极产物Fe2+立即氧化生成Fe3+,Cr2O2-7本身被还原生成Cr3+,反应为:
Cr2O2-7+6 Fe2++14H+=2 Cr3++6 Fe3++7H2O
Cr3+、Fe3+都是+3价阳离子,容易发生水解反应:
Cr3++3H2O![]() Cr(OH)3↓+3H+
Cr(OH)3↓+3H+
Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
由于阴极H+放电生成H2和阳极Cr2O2-7氧化Fe2+,均消耗大量H+,溶液的酸性不断减弱,减小了水解平衡中生成物[H+],促使Cr3+和Fe3+水解平衡向右移动,生成Cr(OH)3沉淀和Fe(OH)3沉淀.
若用石墨做电极,则阳极生成Cl2,得不到Fe2+;缺少还原剂,便不能使Cr2O2-7还原成Cr3+再生成Cr(OH)3沉淀而除去.
解 (1)增强废水导电能力利于加快电解反应.
(2)Fe-2e-=Fe2+;2H++2e-=H2↑
(3)①Cr2O2-7+6Fe2++14H+=2Cr3++6Fe3++7H2O
②Cr3++3H2O![]() Cr(OH)3↓+3H+
Cr(OH)3↓+3H+
③Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
(4)阴极H+放电生成H2和阳极Cr2O2-7氧化Fe2+,均消耗大量H+,减小了水解平衡中生成物[H+],促使Cr3+和Fe3+水解平衡向右移动,生成沉淀.
(5)不能,因为石墨为阳极时,阳极生成O2,得不到Fe2+;缺少还原剂,不能使Cr2O2-7还原成Cr3+再转化为Cr(OH)3沉淀而除去.
【例7】 (2001湖北)某学生试图用电解法根据电极上析出物质的质量来验证阿佛加德罗常数值,其实验方案的要点为:①用直流电电解氯化铜溶液,所用仪器如下图所示;②在电流强度为I安,通电时间为t秒后,精确测得某电极上析出的铜的质量为m克.试回答:
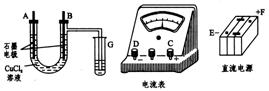 |
(1)连接这些仪器的正确顺序为(用图l—3—4中标注仪器接线柱的英文字母表示,下同)E接 ,C接 , 接F.实验线路中的电流方向为: → → →C →
→ .
(2)写出B电极上发生反应的离子方程式 .
试管中淀粉KI溶液变化的现象为 ,相应的离子方程式是 .
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序(选填下列操作步骤的编号)应是 .
①称量电解前电极质量. ②刮下电解后电极上的铜并清洗.③用蒸馏水清洗电解后电极.④低温烘干电极后称量.⑤低温烘干刮下的铜后称量.⑥再次低温烘干后称量至恒重.
(4)已知电子的电量为1.6×10-19库仑,试列出阿佛加德罗常NA的计算表达式:NA .
分析 (1)该电解装置的特点是B电极上有氯气生成,G的是检验氯气,溶液中Cl-在B电极上失电子,氧化成氯气,说明是阳极,则B一定接电源的正极F;那么,电极A为阴极,应接电源负极E.而电流表既可接在B与F之间,也可接在A与E间.连必须注意电流表的“+”应与电源的“+”相接,或电流表的“—”电源的“—”相接.
故只有两种正确的连接顺序:①F接C→D接B→A接E,②E接D→C接A→B接F,接法②与题意符合.故②为正确答案.
电子流向从电源负极经电解装置流回电源正极,即电子流向为E→D→C→A→B→F,而电流方向与电子流向相反,故电流方向为F→B→A→C→D→E.
(2)G管用来检验和吸收氯气,故B电极上的反应为:2Cl--2e-=Cl2↑,G管中发生反应:Cl2+2I-=2Cl-+I2,碘遇淀粉溶液变蓝色.
(3)要准确称量铜的质量,绝对不能刮去电极上的铜来称量,因为石墨较软,很容易刮下,刮下的就是铜和石墨,故正确的选项中不能有②和⑤.
则正确的操作顺序为先称电解前A电极的质量,电解后电极上吸附有电解质离子,必须用蒸馏水小心清洗,故③是必要的,烘干除水也是必要的,故④是必选的,只有两次称量的质量相等时,才能证明电极上的水已烘干净,故⑥是正确的.
因此应选①、③、④、⑥.
(4)由于电流表与电解槽是串联的,通过的电量是相等的,故有:
×2×NA×l.6×10-19=It NA=
解 (1) E接D→C接A→B接F;电流方向为F→B→A→C→D→E.
(2) 2Cl--2e-=Cl2↑;变蓝色;Cl2+2I-=2Cl-+I2.
(3)①、③、④、⑥.(4) NA=