高三化学调研测试
考试说明:1、本卷满分150分,考试时间120分钟
2、可能用到的数据:
原子量: H 1 C 12 N 14 O 16 Na 23 Si 28 S 32 Cl 35.5 K 39 Ca 40 Mn 55 Fe 56 Cu 64 I 127 Hg 201
第Ⅰ卷(选择题共72分)
一、选择题(本题包括8小题,每小题4分,共32分.每小题只有一个正确选项符合题意.)
1.新华社1999年11月17日电,在兰州召开的一次能源地质国际研讨会传出讯息:“可燃冰”将帮助人类摆脱日益临近的能源危机。“可燃冰”是水与天然气相互作用形成的晶体物质,主要存在于冻土层和海底大陆坡中;据测定每0.1 m3固体“可燃冰”可释放出20 m3的甲烷气体。由此可判断下列说法中不正确的是 ( )
A.“可燃冰”将成为人类新的后续能源
B.“可燃冰”是水变油,属化学变化
C.“可燃冰”具有使用方便、清洁卫生等优点
D.青藏高原的冻土层可能存在“可燃冰
2.人的血液总是维持在PH=7.37~7.45范围内,这是由于 ( )
A.人体中有大量水分(占体重70%) B.血液中氯化钠保持一定浓度
C.排出的二氧化碳溶解在血液中 D.血液中HC03-和H2C03的浓度稳定在一定范围内
3.某温度下,w g某物质在足量氧气中充分燃烧,其燃烧产物立即与过量的Na2O2反应,固体质量增加w g。在①H2 ②CO ③CO和H2的混合气 ④HCHO ⑤CH3COOH
⑥HO—CH2—CH2—OH中,符合题意的是 ( )
A.均不符合 B.只有①②③ C.只有④⑤ D.全部符合
4.在一定温度下,NH4NO3分解的化学方程式为:5NH4NO3![]() 2HNO3+4N2+9H2O在此反应中被氧化和被还原的氮原子数之比是
( )
2HNO3+4N2+9H2O在此反应中被氧化和被还原的氮原子数之比是
( )
A.5∶3 B.5∶4 C.1∶1 D.3∶5
5.由极性键构成的非极性分子是 ( )
A.O2 B.NH3 C.C02 D.HCN
6.已知A2O![]() 可与B2-反应,B2-被氧化,产物为B单质,A2O
可与B2-反应,B2-被氧化,产物为B单质,A2O![]() 被还原,产物为A3+,且知100
mL c(A2O
被还原,产物为A3+,且知100
mL c(A2O![]() )=0.3 mol·L-1的溶液与150
mL c(B2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为
( )
)=0.3 mol·L-1的溶液与150
mL c(B2-)=0.6 mol·L-1的溶液恰好完全反应,则n值为
( )
A.4 B.5 C.6 D.7
7.遇有下列情况,处理不当的是 ( )
A.不小心将少量浓硫酸沾到皮肤上,立即用水冲洗
B.皮肤上沾有苯酚时,立即用酒精擦洗
C.误食重金属盐,立即喝生牛奶或蛋清
D.金属钠着火,立刻用砂子覆灭
8.过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,他可由冰醋酸
与过氧化氢在一定条件下制得;他可以迅速杀灭多种微生物,包括多种病毒(如:SARS
病毒)、细菌、真菌及芽孢,有关过氧乙酸的叙述正确的是 ( )
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸可与苯酚混合使用
C.由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应
D.浓过氧乙酸中加入少许紫色石蕊试液,振荡后试液一定呈红色
二、选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
9.维生素E在国外美称之“生命奇迹丸”,是一种脂溶性维生素,对抗衰老等有特殊作用,
经研究发现维生素E有α、β、γ、δ四种类型,其结构简式如下:
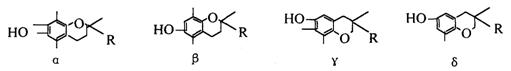
其中R为-CH2CH2CH2[CH(CH3)CH2CH2]2CH(CH3)2即:

上述互为同分异构体的是 ( )
A.α β B.β γ C.γδ D.α δ
10.某温度下,在一容积可变的容器中,反应2A(S)十B![]() 2C(g);△H>0,达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,当采取下列措施能使平衡向正反应方向移动的是 ( )
2C(g);△H>0,达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,当采取下列措施能使平衡向正反应方向移动的是 ( )
A.升高温度 B.加入催化效果更好的催化剂
C.A、B、C均增加1mol D.A、B、C的量均减半
11.①将0.1
L 1.0 mol·L-1的纯碱溶液逐滴滴入0.1
L 1.25 mol·L-1的盐酸中 ②将0.1
L 1.25 mol·L-1的盐酸逐滴滴入0.1
L 1.0 mol·L-1的纯碱溶液中。两种操作相比较,反应后产生的c(HCO![]() )大小关系为
( )
)大小关系为
( )
A.①中大 B.②中大 C.①②中相等 D.无法确定
12.下列离子反应方程式正确的是 ( )
A.氯气与水反应:Cl2 +H2O =Cl-+2H++ClO-
B.氨气通入醋酸溶液中NH3+H+=NH4+
C.氯化铁溶液显弱酸性:Fe3++3H2O![]() Fe(OH)3 +3H+,
Fe(OH)3 +3H+,
D.碳酸氢钠溶液中加入过量石灰水HCO3-+OH-=CO32-+H2O
13.固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆一氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2- )在其间通过。该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是 ( )
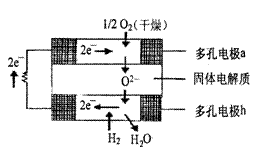 A.有O2参加反应的a极为电池的负极
A.有O2参加反应的a极为电池的负极
B.有H2参加反应的b极为电池的正极
C.a极对应的电极反应式为O2+2H20-4e=40H-
D.该电池的总反应方程式为:2H2+02=2H2O
14.X和Y两元素的阳离子具有相同的电子层结构。X元素的阳离子半径大于Y元素的阳离子半径。Z和Y两元素的核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。则X、Y、Z三种元素原子序数的关系是 ( )
A.X>Y>Z B.Y>X>2 C.Z>X>Y D.Z>Y>X
15.以NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol辛烷分子中所含共价键数为25 NA
B.标准状况下,11.2L臭氧中含有![]() 个氧原子
个氧原子![]()
C.2g重氧水(H218O)、含有![]() 个中子
个中子
D.84gNaHC03晶体中含有![]() 个CO32-
个CO32-
16.硝酸铜是制备Cu-Zn-AI系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用
①Cu与稀硝酸反应制取,3Cu+8HN03=3Cu(NO)2+2NO↑+4H20
②Cu与浓硝酸反应制取,Cu+4HN03=Cu(NO3)2+2N02↑+2H20
③通氧气于铜屑与稀硝酸的体系中制取,2Cu+4HN03+02=2Cu(N03)2+2H2O
下列说法不正确的是 ( )
A.制取相同量的硝酸铜需硝酸的量③最少
B.制取相同量的硝酸铜①产生的有毒气体比②少
C.三种方案中硝酸的利用率③>②>①
D.三种方案的反应都可以在铁制容器中进行
17.经测定某溶液中只含NH4+、C1- 、H+、OH-四种离子,下列说法错误的是 ( )
A.溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3·H20
C.若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质一定只有NH4Cl
D.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
18.某稀溶液中含有Fe(NO3)3 、Cu(NO3)2 、HN03,若向其中逐渐加入铁粉,溶液中Fe2+浓度和加入铁粉的物质的量之间的关系如下图所示。则稀溶液中Fe(N03)3、Cu(NO3)2、HN03物质的量浓度之比为
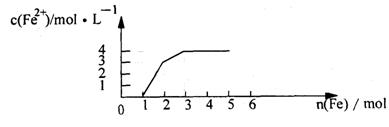
A.1:1:1 B.1:3:1 C.3:3:8 D.1:1:4
第Ⅱ卷(非选择题共78分)
三、(本题包括19、20两小题,共23分)
19.(7分)在0.5mol·L:纯碱溶液中滴入酚酞试液变红,若在该溶液中再逐滴滴入过量BaCl2溶液,所观察到的现象是(1)_______________________________________ (2)其原因是________________________________________ (用离子反应方程式和简要文字说明)。
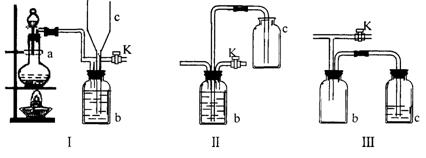 20.(16分)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
20.(16分)在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
试回答:
(1)若用[Ⅰ]取氯气,b瓶加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时如若发现c中液面不明显上升,你分析可能的原因是__________________________检查的简单方法是_________________________
(2)装置[Ⅰ]中b能防止多余气体逸散的原因是:___________________________
(3)欲用[Ⅱ]或[Ⅲ]代替[Ⅰ]中的b~c部分(选用液体相同),是否可行?说明理由。
[Ⅱ]是否可行(填“是”或“否”) _____________理由是___________________________
[Ⅲ]是否可行(填“是”或“否”) _____________理由是______________
四、(本题包括21.22两小题,共17分)
21.(5分)两种元素的核外电子层数之比与最外层电子数之比相等,则在周期表的前18号元素中,满足上述关系的元素组合有(不一定填满):
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |
| 元素符号 | H.Be |
|
|
|
|
|
|
22.(12分)已知:D.E.F.K.L为气体,E能使澄清石灰水变浑浊,I是金属,1molA在反应①中转移的电子的物质的量为1mol,B.H是常见的化肥,它们有如下图所示转化关系(部分反应中生成的水已略去):试回答下列:
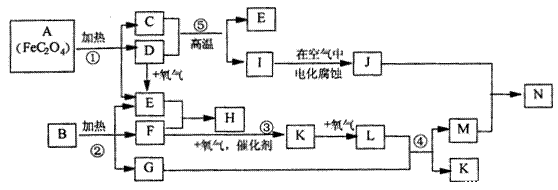
(1)写出化学式;C__________D _____________H ____________N
______________
(2)写出反应①的方程式:
(3)写出离子反应方程式 I+M—N+K:____________________________
五、(本题包括23、24两小题,共20分)
23.(10分)有机物A-H能发生下图所示一系列变化
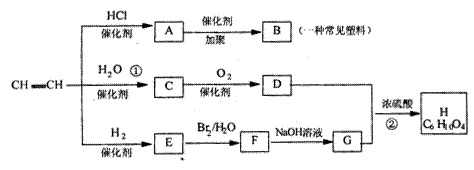

试回答下列:
(1)写出化学式:A ____________ B _____________ E ___________ F___________
(2)写出化学方程式:
①____________________________________②_______
(3)C、G、H中与等物质的量乙炔燃烧消耗氧气相同的化合物是___________(填字母)
24.(10分)已知
(1) (R和R’代表烃基) RNH2+R’CH2Cl![]() RNHCH2R’
RNHCH2R’
(2)苯的同系物能被高锰酸钾氧化,如: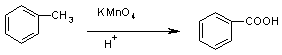
(3) (苯胺,弱碱性,易被氧化)
(苯胺,弱碱性,易被氧化)
化合物C是制取消炎灵(盐酸祛炎痛)的中间产物,其合成路线为:


请回答下列问题:
(1)反应⑤的主要产物C中含有___________种官能团(除苯环外)
(2)B物质的结构简式是 ______________________。
(3)反应①②的化学方程式①__________________________②
(4)上列转变过程中属于取代反应的是
六、(本题包括25、26两小题,共18分)
25.(9分)在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分反应,下图表示加入固体的的质量与产生气体的体积(标准状况)的关系。试计算:
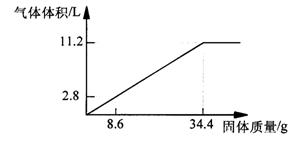
(1)NaOH溶液的物质的量浓度是___________ mol·L-1
(2)当NaOH溶液为140mL,固体为51.6g时,充分反应产生的气体为 ____ L(标准状况)
(3)当NaOH溶液为180mL,固体仍为51.6g时,充分反应产生的气体为____L(标准状况)。
26.(9分)2mol丁烷气体与一定量氧气共贮于一固定体积的容器中,压强为7kPa,点火燃烧后回到室温,容器只存在一定量的水(其体积可以忽略不计)和CO、CO2两种气体,总压强为4kPa。求:
(1)生成水的质量;
(2)反应前氧气的物质的量;
(3)反应后气体中CO2和CO的物质的量。
参考答案及评分标准
一、选择题(每题4分,共32分)
1.B 2.D 3.D 4.A 5.C 6.D 7. A 8.A
二、选择题(每题4分,共40分)
9.B 10.AC 11.B 12.C 13.D 14.D 15.AC 16.CD 17.AC 18.D
三、19.(共7分)
(1)生成白色沉淀,红色消失(4分,每个现象得2分) (2)Ba2++CO32-=BaCO3↓,CO32-浓度减少,使平衡CO32-+H2O![]() HCO3-+OH-向逆反应方向移动,C(CO32-)减少趋近于10-7mol·L-1 (3分)
HCO3-+OH-向逆反应方向移动,C(CO32-)减少趋近于10-7mol·L-1 (3分)
20.16分,每空均2分 (1) (6分)饱和食盐水;装置漏气;用湿润的碘化钾淀粉试纸先靠近各边接口处检验,漏气处试纸变蓝 (涂肥皂水等合理方法均可)
(2) (2分)关闭活塞后,若a中仍有气体发生,气体压强增大。将b中液体压入c中,整个装置成为储气装置,不会有气体逸出。 (2) (4分)是,原理与装置I同
(4分)否,c瓶因密闭,体积不能改变,压强增大时有危险
四、21.(每空1分,共5分)
| He、C | H、Al | He、S | Be、Al | C、S |
22.(每空2分,共12分) (1)FeO;CO;CO(NH2)2;Fe(NO3)3,或Fe(NO3)2
(2)NH4HCO3 =NH3↑+H2O+CO2↑或(NH4)2CO3 =2NH3↑+H2O +CO2↑
(3)Fe+4H++NO3-=Fe3++NO↑+2H2O或3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O
五、23.(10分) (1)CH2=CHCl , [CH2CHCl]n CH2=CH2 CH2Br=CH2Br (每格1分)
(2)CH=CH+H2O ![]() CH3CHO
CH3CHO ![]() (2分)
(2分)
2CH3COOH+HOCH2CH2OH![]() CH3COOCH2CH2OOCCH3+2H2O
(2分) (3)C.G
(2分)
CH3COOCH2CH2OOCCH3+2H2O
(2分) (3)C.G
(2分)
24.(每空2分,共10分)
(1)二种(2)![]() (3)
(3)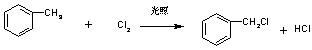
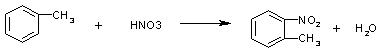 (4)①、②
(4)①、②
六、
25.(每空3分,共9分) (1)5 mol·L-1 (2)15.68L (3) 16.8L
26.(9分,每格3分) (1)180g (2)12 mol (3)CO 2 mol CO2 6 mol