高考化学模拟考试
化 学
![]() 可能用到的原子量: H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27
可能用到的原子量: H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27
S—32 Cl—35.5 Ca—40 Zn—65 Fe—56 Ag—108 Ba—137 K—39 Cu—64 F—19 Br—80 I—127 P—31 Si—28 Mn—55
第I卷 选择题(共68分)
一、选择题(本题共8小题,每小题3分,共24分。每小题只有一个正确选项)
1.火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭表面温度过高,可在火箭表面涂上一种特殊的化学物质,该物质最可能具有的性质是
( )
A.硬度很大、熔点很高 B.高温下可分解气化
C.良好的热稳定性 D.较强的还原性,易燃烧
2.下列物质呈固态时必为分子晶体的是 ( )
A.非金属氧化物 B.非金属单质 C.含氧酸 D. 金属氧化物
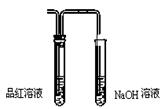
3.某消毒液无色,用红色石蕊试纸检验,发现试纸先变蓝后褪色,则该消毒液的主要成分可能是 ( )
A.KMnO4 B.NaClO C.H2O2 D.Cl2
4.下列事实与氢键有关的是 ( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
5.在某未知溶液中再溶解一定量的CH3COONa晶体,测得c(Na+)与c(CH3COO-)几乎相等,则原未知溶液可能是 ( )
A.HCl溶液 B.NaOH溶液 C.KCl溶液 D.KOH溶液
6.下图是某有机物分子的比例模型,有关该物质的推断不正确的是 ( )
 A.分子中可能含有羟基
A.分子中可能含有羟基
B.分子中可能含有羧基
C.分子中可能含有氨基
D.该物质的分子式可能为C3H6O3
7.若某装置中发生如下反应:Cu+2H+=Cu2++H2↑,关于该装置的有关说法不正确的是 ( )
A.该装置一定为原电池 B.该装置一定为电解池
C.金属铜为电解池的阳极 D.电解质溶液可能是硝酸溶液
8.已建立化学平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列有关叙述正确的是 ( )
A. 生成物的质量分数一定增加 B. 反应物的转化率一定增大
C. 正反应速率一定增大 D. 正反应速率一定大于逆反应速率
二、选择题(本题包括11小题,每题4分,共44分。每小题有1~2个正确选项。若正确答案包括两个选项,只选一个且正确2分,选两个且都正确4分;但只要选错一个,该小题 0分)
9. 下列各组离子在碱性条件下可以大量共存,而在强酸性条件下能发生氧化还原反应的是
( )
A.Ca2+、Fe2+、NO3-、Cl- B.K+、Mg2+、HCO3-、PO43-
C.Na+、K+、SO42-、SO32- D.Ba2+、Na+ 、I-、NO3-
10.据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机
![]() 电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电
电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电
池反应为:2CH3OH + 3O2 + 4OH— 2CO32— + 6H2O,则下列说法错误的是 ( )
A.放电时CH3OH参与反应的电极为正极
B.充电时电解质溶液的pH逐渐增大
C.放电时负极的电极反应为:CH3OH-6e- +8OH- = CO32— + 6H2O
D.充电时每生成1 mol CH3OH转移6 mol电子
11. 由一种阳离子与两种酸根离子组成的盐称为混盐,混盐CaOCl2在酸性条件下可以产生氯
气,下列关于混盐CaOCl2的有关判断,不正确的是 ( )
A.该混盐具有较强的氧化性
B.该混盐中氯元素的化合价为+1价和—1价
C.该混盐与硫酸反应产生1mol Cl2时转移2NA个电子
D.该混盐的水溶液显酸性
12. 有某硫酸和硝酸的混合溶液20mL,其中含有硫酸的浓度为2mol·L-1,含硝酸的浓度为1mol·L-,现向其中加入0.96g铜粉,充分反应后(假设只生成NO气体),最多可收集到标况下的气体的体积为 ( )
A.89.6mL B.112mL C.168mL D.224mL
13. 某研究性学习小组想用实验证明高锰酸钾溶液的紫红色是MnO4-离子的颜色,而不是
K+离子的颜色,他们设计的下列实验步骤中没有意义的是 ( )
A.将高锰酸钾晶体加热分解,所得固体质量减少
B.观察氯化钾溶液没有颜色,表明溶液中K+无色
C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应
D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO4-离子为紫红色
14. PH=3的二元弱酸![]() R溶液与V升pH=11的NaOH溶液混合后,混合液的pH=7.下列判断正确的是
( )
R溶液与V升pH=11的NaOH溶液混合后,混合液的pH=7.下列判断正确的是
( )
A.溶液总体积为2V升
B.溶液中2c(![]() )+c(
)+c(![]() )=c(
)=c(![]() )
)
C.溶液中c(![]() )+c(
)+c(![]() )=c(
)=c(![]() )+c(
)+c(![]() )
)
D.溶液中c(![]() )>c(
)>c(![]() )>c(
)>c(![]() )=c(
)=c(![]() )
)
15. 2005年2月18日英国食品标准署就食用含有添加苏丹红色素的食品可能诱发癌症向
消费者发出警告。苏丹红是一种工业合成染色剂,但却被滥用作食品的着色剂,严重危害
了人们的身体健康.苏丹红1的结构简式如下图,有关它的叙述不正确的是 ( )
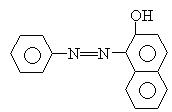
A.该物质中所有原子可能处于同一平面
B.1mol该物质可与1mol Br2发生取代反应
C.其的摩尔质量为176 D.该物质极易溶于水
16. 在一定条件下,RO3—与R—发生如下反应:RO3—+5R—+6H+ ===3R2+3H2O,下列关于R元素的叙述正确的是 ( )
A.R位于VIIA族
B.R的氢化物的水溶液属于强酸
C.RO3—中的R只能被还原
D.R2在常温常压下一定是气体
17.下列离子方程式中正确的是 ( )
A.向明矾溶液中加入Ba(OH)2溶液至Al3+刚好完全沉淀:
Al3+ + SO42— + 3OH— + Ba2+ === BaSO4↓ + Al(OH)3↓
B.氟气和水反应
2F2 + 2H2O === 4H+ + 4F— + O2
C.向澄清石灰水中加入少量小苏打溶液
Ca2+ + OH— + HCO3— === CaCO3↓+ H2O
D.铜片投入稀HNO3溶液
Cu + NO3— + 4H+ === NO↑+ 2H2O + Cu2+
18. 可逆反应aA(s)+bB(g) ![]() cC(g)+dD(g) ;ΔH=Q反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图
cC(g)+dD(g) ;ΔH=Q反应过程中,当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如下图
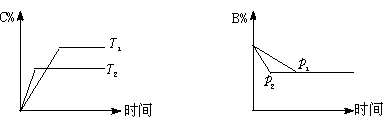
据图分析,以下正确的是 ( )
A.T1>T2 ,Q>0 B.T1<T2 ,Q<0 C.p1>p2,a+b =c+d D.p1<p2 ,b = c+d
19. 下列各组物质用一种试剂不能加以鉴别的是 ( )
A.NaCl溶液、MgCl2溶液、KNO3溶液、Al2(SO4)3溶液
B.苯、苯酚溶液、己烯和乙醇
C.Na2SO4溶液、Na2SO3溶液、Na2CO3溶液、NaAlO2溶液
D.NaCl溶液、NH4Cl溶液、(NH4)2SO4溶液、Na2SO4溶液
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
|
| 答案 |
|
|
|
|
|
|
|
|
|
|
第II卷 (非选择题 共82分)
三、(本题有2小题,共22分)
20.(8分)(1)硫酸铜晶体结晶水含量测定的实验,包括研磨、加热、称量等操作步骤。其中判断硫酸铜晶体完全失水的定性实验现象是_________ ______________ ___ ____,完成测定过程至少要进行 次称量操作。
(2)比较分析是化学学习中重要的学习方法,也是我们学习中解决问题的重要思想。某
同学在进行镁铝性质实验时,发现用铝分别与H+浓度相同的稀硫酸和稀盐酸反应时,实验
现象明显不同,在铝与硫酸的反应中,产生的气泡很少。从反应本质看,两者的实验现象
应该相同。在不考虑实验条件、操作和药品纯度的情况下,请你对上述实验现象提出假设,
并设计一简单的实验来验证你的假设。你的假设是
,实验操作和现象是
。
21.(14分) 某研究性学习小组的同学对绿矾受热分解的情况进行探究。
(1)资料表明,在加热条件下三氧化硫具有比较强的氧化性。甲同学认为,绿矾受热分解的产物是FeO、SO3、H2O。你支持甲同学的观点吗?说明你的理由 ;
(2)实验是解决问题的重要手段。乙同学用如下装置通过实验来探究绿矾受热分解的产
物情况(加热及夹持装置未画出): 实验过程中发现:装置A中有残留固体,装置B中
无水硫酸铜变蓝,装置C中的U形管中有无色晶体出现。
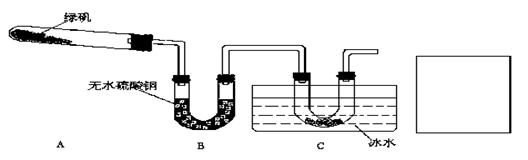 回答下列问题:
回答下列问题:
① 在装置C导管出口处还应有的实验现象是
;
②装置A中残留的固体是 ;装置C中的U形管中无色晶体是 ;
③乙同学为了验证绿矾受热分解的所有产物,在C装置后连接了一个装置,并选用了合适的药品不仅达到了实验目的而且还起到了一举两得的效果。请你在C装置后的方框中画出该装置,并注明选用的药品。
④写出绿矾受热分解的化学方程式 。
四、(本大题有2小题,共22分)
22.(10分)下图中A~J分别代表相关反应中的一种物质,已知A受热分解得到相同物质的量的B、C、D(图中有部分生成物未写出)。
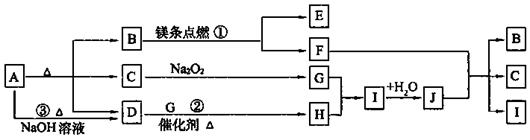
请填写以下空白:
(1)B的电子式为 ,D分子的空间构型为 。
(2)写出反应①、②的化学方程式:
① ;
② 。
(3)反应③的离子方程式为: 。
23.(12分)我国研制的长征捆绑式火箭在第一、二级发动中用“偏二甲(基)肼”和四氧化二氮作为液体燃料。
(1) 已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其
余为氮;又知其分子中有一个氮原子不与氢原子相连。通过计算写出偏二(基)肼的化学式和分子结构简式:
(2) 在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该燃烧反应的化学
方程式(反应中所有的氮元素均转化为N2)。
五、(本大题有2小题,共18分)
24.(8分)某烃的含氧衍生物A的相对分子质量为240,其碳的质量分数为80.0%,氧的质量分数是氢的质量分数的2倍,分子中含有2个苯环,每个苯环上都只有一个取代基,该取代基无支链。A在稀酸溶液中加热时发生水解,得到B和C,C的相对分子质量为108。请写出:
(1)A的分子式 。
(2)C的结构简式 。
(3) B的结构简式 。
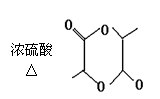
25.(10分)已知羧酸在磷的催化条件下可以和卤素反应生成α-卤代物(与羟基相邻的碳原子上的氢原子被取代):
P
![]() RCH2COOH+Cl2
RCHCOOH+HCl
RCH2COOH+Cl2
RCHCOOH+HCl
Cl
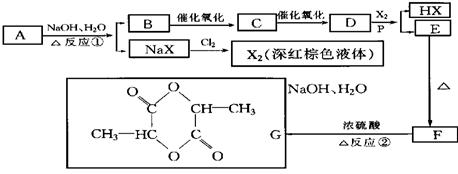
(1)写出有机物A、C、D的结构简式:
A. ,C. ,D. 。
(2)写出下列反应的化学方程式:
反应①: 。
反应② 。
六、(本大题2小题,共20分)
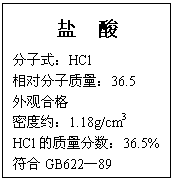 26.(8分)右图为某市售盐酸试剂瓶标签上的部分数据。问:
26.(8分)右图为某市售盐酸试剂瓶标签上的部分数据。问:
(1)该盐酸的物质的量浓度为多少?(列式计算)
(2)取该盐酸25.4mL与2.00mol/L的氢氧化钠溶液100mL
混合,再将混合后溶液稀释至1.00L,此时溶液的pH约为多少?
27.(12分)将Na2O2和NaHCO3的混合物等质量分成两份,其中一份加100mL稀盐酸,使其充分反应,溶液呈中性,放出气体2.24L。将气体通入另一份混合物中充分反应后,气体体积变为2.016L。请计算:
(1)原混合物中Na2O2和NaHCO3的物质的质量之比
(3) 盐酸溶液的物质的量浓度(气体体积在标准状况下测定)
高 考 模 拟 考 试
化学参考答案
一、二选择题
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 答案 | B | C | B | B | D | C | A | D | D | A |
| 题号 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
|
| 答案 | CD | D | A | B | CD | AB | C | BD | A |
|
三、(本题有2小题,共22分)
20.(8分)(1)蓝色硫酸铜晶体完全变成白色粉末 4
(2)硫酸根离子对铝与氢离子的反应有抑制作用等 在铝与盐酸的反应溶液中,加入Na2SO4固体,观察反应速率是否减慢(其他合理答案同样给分) (各 2分)
21.(14分)(1)不支持 FeO有还原性,SO3有氧化性,受热时要发生氧化还原反应(3分)
(2)①在C装置的导管出口处有刺激性气味 (2分)
|
③
(3分)(其他合理答案同样给分)
④2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O(2分)
Fe2O3+SO2↑+SO3↑+14H2O(2分)
四、(本大题有2小题,共22分)
22.(10分)(每空2分,共10分)(1) ![]() 三角锥形
三角锥形
|
| ||||
(2)2Mg+CO2 2MgO+C; 4NH3+5O2
4NO+6H2O
|
(3)NH4++HCO3-+2OH-+2OH NH3↑+CO![]() +2H2O
+2H2O
23、(12分)
(1)C:60×0.4=24 =2
H:60×0.1333=28 =8
N:60-24-8=28 =2
C2H8N2
(2)C2H8N2 + 2N2O4=2CO2↑ + 4H2O↑ + 3N2↑
五、(本大题有2小题,共18分)
24.(8分)(1)C16H16O2 (2)
![]()
25.(10分)(每空2分,共10分)(1)CH3CH2CH2Br;CH3CH2CH2OH;CH3CH2CHO
|
![]() (2)CH3CH2CH2Br+NaOH
CH3CH2CH2OH+NaBr
(2)CH3CH2CH2Br+NaOH
CH3CH2CH2OH+NaBr
![]() (或CH3CH2CH2Br+H2O+H2O
CH3CH2CH2OH+HBr)
(或CH3CH2CH2Br+H2O+H2O
CH3CH2CH2OH+HBr)
 |
![]() 2CH3CH2COOH
+2H2O
2CH3CH2COOH
+2H2O
OH
六、(本大题2小题,共20分)
26.(8分)(1)c(HCl)=1000×1.18×36.5%÷36.5 =11.8mol·L-1(3分)
(2)n(HCl)=11.8×0.0254=0.300mol
n(NaOH)=2.00×0.01=0.200mol (3分)
pH=1g(0.300-0.200)/1=1 (2分)
27、(12分)2Na2O2 + 4HCl === 4NaCl + O2↑ + 2H2O
NaHCO3 + HCl === NaCl + CO2↑ + H2O
产生CO2和O2的物质的量=![]() ,生成的CO2和O2的混合气通入另一份Na2O2和NaHCO3的混合物中,只能发生下列反应 2CO2+ 2Na2O2 === 2Na2CO3
+ O2 ,反应后的气体体积变为
,生成的CO2和O2的混合气通入另一份Na2O2和NaHCO3的混合物中,只能发生下列反应 2CO2+ 2Na2O2 === 2Na2CO3
+ O2 ,反应后的气体体积变为 ![]() 。
(2分)
。
(2分)
讨论:
(1)若Na2O2过量,最后产生的气体全部是O2时:
2CO2 ~ O2 △V
2 1 1
x (0.100-0.0900)mol x =0.0200 mol (2分)
所以NaHCO3 为0.0200mol, O2 为0.100 mol-0.0200 mol=0.0800 mol ,
Na2O2 为0.0800 mol×2=0.160mol ,
n(Na2O2)︰n(NaHCO3)=0.160 mol︰0.0200 mol=8︰1 (2分)
c (HCl)=![]() (2分)
(2分)
(2)若Na2O2不足量,产生气体为CO2和O2的混合物:
2Na2O2 ~ O2 △V
2 1
y (0.100-0.0900)mol y=0.0200 mol (2分)
所以 Na2O2为0.0200mol,
生成O2 为0.0100mol,生成CO2为 0.100 mol-0.0100 mol=0.0900 mol ,
NaHCO3 为0.0900mol ,
n(Na2O2)︰n(NaHCO3)=0.0200 mol︰0.0900 mol=2︰9 (2分)
c (HCl)=![]() (2分)
(2分)