高考化学模拟试卷(二)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分。考试时间120分钟。
第Ⅰ卷(选择题,共74分)
可能用到的相对原子质量:H-1,C-12,O-16,Mg-24,Fe-56,Zn-65
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意)
1. 2002年由德、法、美等国科学家组成的科研小组,通过粒子加速实验,获得
|
A.该原子中子数与质子数之差为3 B.这是一种新元素
C.45Fe和56Fe化学性质相同 D. 45Fe和56Fe互为同素异形体
2.目前市场上纯净水的品种很多,其中有些是不法商贩为牟取暴利,用自来水冒充。为辨别真假,可用下列一种化学试剂来鉴别,该试剂是( )
A.酚酞试液 B.BaCl2溶液 C.NaOH溶液 D.AgNO3溶液
3.下列各组离子在溶液中既可以大量共存,且加入过量氨水后也不产生沉淀的是( )
A.Na+、Ba2+、Cl-、SO42- B.K+、AlO2-、NO3-、OH-
C.H+、NH4+、Al3+、SO42- D.H+、Cl-、CH3COO-、NO3-
![]() 4.对于反应:N2+3H2 2NH3,下列各数据表示在不同条件下的反应速率,其中反应进行的最快的是( )
4.对于反应:N2+3H2 2NH3,下列各数据表示在不同条件下的反应速率,其中反应进行的最快的是( )
A.VN2=0.01mol/(L•s) B.VH2=0.02mol/(L•s)
C.VH2=0.60mol/(L•min) D.VNH3=1.0mol/(L•min)
5.下列物质中所有原子都满足最外层8电子结构的是( )
A.XeF6 B.COCl2(光气) C.HClO D.PCl5
6.下列物质由于长久露置于空气中会发生颜色变化的是( )
![]() ①FeSO4•7H2O ②Fe(OH)2 ③氯水(新制)
④
⑤Na2SO3 ⑥Na2O2
①FeSO4•7H2O ②Fe(OH)2 ③氯水(新制)
④
⑤Na2SO3 ⑥Na2O2
A.①②③④⑥ B.①②④⑥ C.②③④ D.①②③④⑤⑥
7.a g下列物质完全燃烧后的产物通过足量的Na2O2,Na2O2增重a g,则该物质不可能是( )
A.H2 B.CO C.C2H5OH D.CH3COOH
8.经研究通过“组合转化”技术,能把过多的CO2转化为有益于人类的物质。如将CO2与H2混合,在一定条件下以1:4的比例发生反应,生成某种重要的化工原料和水,该化工原料可能是( )
A.烷烃 B.烯烃 C. 炔烃 D.芳香烃
二、选择题(本题包括10小题,每小题5分,共50分。每小题有一个或二个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分)
9.在化学反应中有许多规律可循。根据化学反应的有关规律,判断下列各组中的两个反应遵循的反应原理相同的组是( )
A.NH3+NaCl+CO2+H2O=NaHCO3+NH4Cl,
MgCO3+H2O![]() Mg(OH)2↓+CO2↑
Mg(OH)2↓+CO2↑
![]() B.CuSO4+H2S=CuS↓+H2SO4, ONa+CO2+H2O→
OH+NaHCO3
B.CuSO4+H2S=CuS↓+H2SO4, ONa+CO2+H2O→
OH+NaHCO3
C.NH4Cl+NaOH=NaCl+NH3•H2O,AgNO3+3NH3•H2O=Ag(NH3)2OH+NH4NO3+2H2O
D.2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑,KBr+H3PO4
Na2SO4+2HCl↑,KBr+H3PO4![]() KH2PO4+HBr↑
KH2PO4+HBr↑
10.下列说法中不正确的是( )
A.一定量的Fe与含1molHNO3的稀硝酸恰好反应,则被还原的氮原子数为NA
B.1molFeCl3溶于沸水中,生成的Fe(OH)3胶粒为NA
C.常温常压下,NA个乙烷分子的体积大于22.4L
 D.1.7g CH5+离子中含有的电子总数为NA
D.1.7g CH5+离子中含有的电子总数为NA
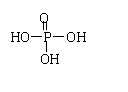
11.已知H3PO4的结构式为 ,两个H3PO4分子可脱去一分子水生成焦磷酸(H4P2O7)。含磷洗衣粉中含三聚磷酸钠(Na5P3O10),则1mol此钠盐中P-O键的物质的量为( )
A.7mol B.8mol C.9mol D.12mol
12.已知100℃时,水的离子积常数为1×10-12。在此温度下,将PH=8的NaOH溶液与PH=4的H2SO4溶液混合后,得到PH=7的混合溶液。则NaOH溶液与H2SO4溶液的体积比约为( )
A.9:11 B.9:1 C.1:9 D.11:9
13.某离子R2+的最外层有2个电子,且有5个电子层,当固体RCl2溶于水配成溶液时,需加入少量单质R和盐酸。据此判断下列叙述正确的是( )
A.R为第ⅡA族元素 B.R存在两种氧化物:RO和RO2
C.R(NO3)2溶液呈中性 D.RCl2具有还原性
14.下列离子方程式正确的是( )
A.苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32-
B.硝酸亚铁溶液中滴加盐酸:3Fe2++NO3-+4H+→3Fe3++NO↑+2H2O
C.乙醛使溴水反应褪色:CH3CHO+Br2+H2O→CH3COOH+2H++2Br-
D.用NaOH溶液吸收过量SO2:2OH-+SO2=SO32-+H2O
15.有机物①CH2OH(CHOH)4CHO;②CH3CH2CH2OH;③CH2=CH-CH2OH;④CH2=CH-COOCH3;⑤CH2=CH-COOH中,既能发生加成、酯化反应,又能发生氧化反应的是( )
A.③⑤ B.①③⑤ C.②④ D.①③
16.已知强酸与强碱在稀溶液里反应的中和热可表示为:H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3KJ/mol。现有在溶液中进行的三个反应:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(l);ΔH=-Q1KJ/mol
1/2H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l);ΔH=-Q2KJ/mol
HNO3(aq)+NaOH(aq)=NaNO3(aq)+H2O(l);ΔH=-Q3KJ/mol
则Q1、Q2、Q3三者关系正确的是( )
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
![]() 17.随着现代科技的发展,各种新型电池不断涌现。银锌电池广泛用于各种电子仪器,其电池反应为:
17.随着现代科技的发展,各种新型电池不断涌现。银锌电池广泛用于各种电子仪器,其电池反应为:
2Ag+Zn(OH)2 Ag2O+Zn+H2O
下列有关说法正确的是( )
A.放电时Ag为负极,充电时Ag为阴极
B.放电时Zn为负极,充电时Zn(OH)2为阴极
C.充电时阳极发生的电极反应为:2Ag+2OH――2e-=Ag2O+H2O
D.该电池的电解质溶液呈酸性
18.50 g镁、锌、铁三种金属组成的混合物,与足量的稀H2SO4充分反应,将反应后所得溶液蒸发得到218g固体(已换算成无水硫酸盐)。则反应中产生的氢气的质量为( )
A.2g B.3g C.3.5g D.4.5g
第Ⅱ卷(非选择题,共76分)
三、(本题包括2小题,共分)
19.如图为苯和溴的取代反应的实验装置图:
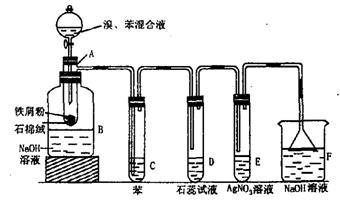
其中A为具支试管的反应容器,在其下端开有一个小孔,塞好石棉绒,再加入少量铁屑。
请回答下列问题:
(1)A中发生的化学反应方程式为 。铁屑的作用是 。
(2)反应一会后,在B中的NaOH溶液里观察到的现象为 。B中NaOH溶液的作用是 ,其化学反应方程式为 。
(3)试管C中苯的作用是 。反应开始后,观察D和E两试管,看到的现象为 。
(4)在上述装置中,具有防倒吸作用的仪器有 。
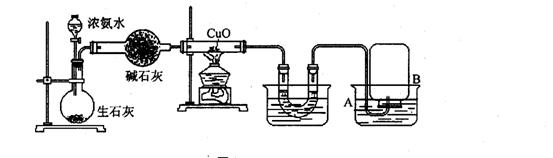
20.某化学兴趣小组自行设计了如下实验的装置来制取氨气,并验证其性质。
其实验现象记录如下:①黑色的CuO粉末变为红色;②生成物A能使无水CuSO4变蓝;③镁带能在另一生成物B中燃烧生成一种固态物质C,C与A反应可生成碱性物质D和一种使湿润的红色石蕊试纸变蓝的气体F。
回答下列问题:
(1)如何检查整套装置的气密性? 。
(2)利用此法制取氨气的原理是: 。
(3)写出在硬质试管中发生的化学方程式 。这个反应说明氨气具有 (填编号:A.碱性 B.还原性 C.氧化性 D.不稳定性)
(4)写出镁带在B中燃烧生成C的反应的化学方程式: ;C的电子式为 。
(5)C与A反应的化学方程式 。
四、(本题包括2小题,共分)
21.已知①A、B、C、D四种物质均含有X元素,有的可能还含有Y、Z元素。元素X、Y、Z的原子序数依次递增。②X在A、B、C、D中都不呈现它的最高化合价。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热催化分解,可制得元素Y的单质。
请回答:
(1)元素Y是 ,(填写元素符号,下同)Z是 。
(2)写出③中反应的化学方程式 。
(3)写出④中反应的化学方程式 。
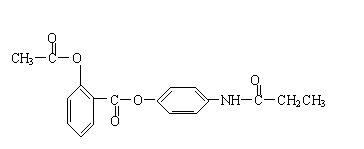
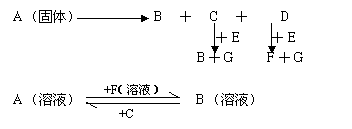 22.下图中A至F是化合物,G是单质。
22.下图中A至F是化合物,G是单质。
写出A、B、E、F的化学式:
A 、B 、E 、F 。
 五、(本题包括2小题,共分)
五、(本题包括2小题,共分)
23.已知有机化合物
在适宜条件下完全水解。
(1) 有机化合物完全水解后得到4种产物,它们的结构简式是:
![]()
、 、 、 。
(2)上述水解产物中,相对分子质量最大的有机物有不同类别的同分异构体。请写出其中含有苯环的同分异构体的结构简式(每一类别只需写一种代表物)。
24.已知下列反应可以发生:
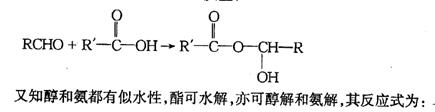
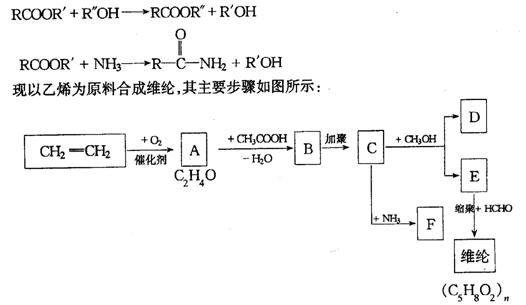
(1)写出下列物质的结构简式:A ,B ,F 。
(2)生成A的化学方程式为: 。
(3)由C生成D和E的化学方程式: 。
(4)E的名称是 ,维纶的结构简式为 。
六、(本题共分)
25.恒温恒容条件下,在一密闭容器中充入n mol A和m mol B,建立平衡aA(g)+bB(g)=cC(g)+dD(g),此时A的体积分数为x%,若向该容器中充入pn molA和qm molB,在相同条件下达到平衡时,A的体积分数为y%。
(1) 若a+b>c+d:
①p、q均大于1,则平衡向 移动(填“正反应”、“逆反应”或“不移动”,下同),y x(填“大于”、“小于”或“等于”,下同);
②p、q均小于1,则平衡向 移动,y x;
③p=q=1,则平衡 移动,y x;
(2) 若a+b<c+d:
①p、q均大于1,则平衡向 移动,y x;
②p、q均小于1,则平衡向 移动,y x;
③p=q=1,则平衡 移动,y x;
26.某学生在课外活动中用一定量的二价金属R和稀硫酸反应制取氢气。所做5次实验结果记录如下表(假设每次实验产生的氢气全部被收集,且体积在同温同压下测定)。
| 实验编号 | R的质量/g | 稀硫酸的体积/mL | 生成氢气的体积/L |
| 1 | 1.5 | 50.0 | 1.47 |
| 2 | 2.0 | 50.0 | 1.96 |
| 3 | 2.2 | 50.0 | 2.16 |
| 4 | 2.5 | 50.0 | 2.16 |
| 5 | 3.0 | 50.0 | 2.16 |
根据上述实验结果进行分析、计算,并回答下列问题:
(1)上述实验中,稀硫酸一定过量的组的编号是 ;
(2)欲求金属R的相对原子质量和稀硫酸的物质的量浓度,利用上表中数据,还需补充的物理量a是 (请注明单位);金属R的相对原子质量的计算式为 (缺少的数据用a表示);稀硫酸的物质的量浓度为 mol/L(缺少的数据用a表示)