高考化学模拟试卷(一)
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共150分,考试时间120分钟。
第Ⅰ卷(选择题 共74分)
可能用到的相对原子质量:H-1,C-12,N-14,O-16,Na-23,S-32,Cl-35.5,K-39,I-127
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.据报道,美国科学家称发现了He-3。下列有关说法正确的是
A.1molHe-3气体质量约为6g B.He-3是氦的同位素
C.He-3是氦的同素异形体 D.氦元素的相对原子质量为3
2.下列过程中,不涉及化学变化的是
A.甘油加水作护肤剂 B.工业上用FeCl3净水
C.烹鱼时加入少量的黄酒和食醋可减少腥味,增加香味
D.烧菜用过的铁锅,经放置常出现红棕色斑迹
3.在2003年抗击非典的斗争中,大量使用了一种高效消毒剂过氧乙酸(CH3COOOH)。已知过氧乙酸具有很强的氧化性、腐蚀性,可以迅速杀灭各种微生物,包括各种病毒(如SARS病毒)、细菌、真菌及芽孢。它可由冰醋酸与过氧化氢及少量硫酸合成。下列有关过氧乙酸的叙述正确的是
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸可与苯酚混合使用
C.由过氧化氢与醋酸制取过氧乙酸的反应属于氧化反应
D.过氧乙酸中加入石蕊试液,试液由紫色变红色
4.下列各组中的试剂相互混合时,无论是哪种试剂过量,产生的现象都相同的是
A.Ca(OH)2(aq)、NaHCO3(aq) B.AgNO3(aq)、NH3•H2O(aq)
C.Al2(SO4)3(aq)、NaOH(aq) D.NaAlO2(aq)、H2SO4(aq)
5.饮用水的消毒剂有多种,其中杀菌能力强且不会影响水质的理想消毒剂是
A.液氯 B.漂白粉 C.臭氧 D.明矾
6.在一定条件下,RO3n-与S2-发生反应的离子方程式为:RO3n-+3S2-+6H+=R-+3S↓+3H2O,则RO3n-中R元素的化合价与R元素原子最外层电子数分别为
A.+5,5 B.+5,7 C.+7,7 D.+6,6
7.汽车发动机的气缸中空气进量过少或过多时,产生的主要有害气体依次是
A.气态烃和NO、NO2等 B.CO和NO、NO2等
C.CO和CO2 D.气态烃和CO2
8.已知含氧酸可用通式XOm(OH)n表示。如:X为S,m=2,n=2,则式子表示H2SO4。一般,通式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是
A.HClO3 B.H2SeO3 C.H3BO3 D.HMnO4
二、选择题(本题包括10小题,每小题5分,共50分;每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给5分,但只要选错一个,该小题就为0分)
9.下列说法正确的是
A.一定条件下,11.2LN2含有的分子数一定为0.5NA
B.78gNa2O2所含的阴离子数为2NA
C.标准状况下,71g氯气所含的原子数为2NA
D.同温同压下,相同体积的任何气体单质所含的原子数相同
10.已知一种PH=3的酸和一种PH=11的碱溶液等体积混合后,溶液呈酸性。其原因可能是
A.浓的强酸和稀的强碱溶液反应 B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应 D.生成了一种强酸弱碱盐
11.1L某溶液中已电离的水是10-13mol,在该溶液中肯定能大量共存的离子组是
A.Mg2+、K+、Cl-、NO3- B.K+、Na+、NO3-、SO42-
C.CO32-、Cl-、Na+、K+ D.NO3-、NH4+、SO42-、K+
12.化学实验室中常将溶液或试剂进行酸化。下列酸化处理的措施中正确的是
A.检验溶液中是否含有SO42-,将BaCl2溶液用HNO3酸化
B.为了增强KMnO4溶液的氧化能力,用盐酸将其酸化
C.检验Fe(NO3)2溶液中的Fe2+时,用盐酸酸化
D.检验卤素离子时,所加的AgNO3溶液用HNO3酸化
13.将1molSO2和1molO2通入一个恒容的密闭容器中,在一定温度和催化剂作用下,反应达到平衡,SO3为0.3mol;此时移去0.25molO2和0.25molSO2,则反应达到新平衡是,SO3的物质的量为
A.0.3mol B.0.225mol C.小于0.225mol D.大于0.225mol,小于0.3mol
14.下列离子方程式书写正确的是
A.向碘化亚铁溶液中通入过量的Cl2:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.向NaClO溶液中通入SO2气体:2ClO-+SO2+H2O=SO32-+2HClO
![]()
![]() C.Na2S溶于水后,溶液呈碱性:S2-+H2O H2S+OH-
C.Na2S溶于水后,溶液呈碱性:S2-+H2O H2S+OH-
D.用惰性电极电解饱和食盐水:2Cl-+H2O OH-+H2↑+Cl2↑
15.NO2、NH3、NO的混合气体26.88L,通过稀硫酸后质量增加45.75g,气体体积缩小为2.24L,将带火星的木条插入其中,木条不复燃,原混合气体的相对平均分子质量为(体积均为标准状况)
A.5.8 B.11.6 C.40.6 D.46.5
16.在一密闭容器中有CO、H2、O2共16.5g,用电火花引燃,使其完全燃烧,再将燃烧后的气体用Na2O2充分吸收,Na2O2增重7.5g,则原混合气体中O2的质量分数是
 A.36% B.54.5% C.40% D.33.3%
A.36% B.54.5% C.40% D.33.3%
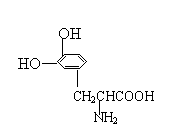
17.L-多巴是一种治疗帕金森综合症的有机物,其结构简式为:
则1mol该化合物发生取代反应消耗Br2的物质的量与NaOH溶液反应消耗NaOH的物质的量分别为
A.2mol、2mol B.2mol、3mol C.3mol、3mol D.3mol、2mol
18.用含有氧化铁、铜屑、铝屑的废铁制备纯净的绿矾,进行如下六项操作:①加入较纯净的铁屑并静置;②过滤后取滤液;③加1∶2的稀硫酸溶解;④过滤后取滤渣;⑤加入过量NaOH溶液并加热;⑥浓缩并结晶。
其正确的操作顺序是
A.①②③④⑥ B.①②⑤④⑥ C.⑤④③①②⑥ D.③②⑤①④⑥
第Ⅱ卷(非选择题,共76分)
三、(本题包括2小题,共分)
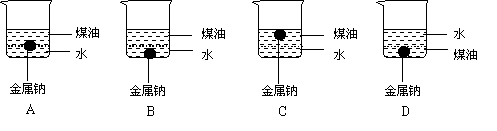
19.如下图所示,向一小烧杯中分别加入等体积的水和煤油,分上下两层,片刻后,再向该烧杯中加入绿豆大小的金属钠,可以观察到的现象有 。
20.某课外兴趣小组在测定一包(质量为ag)已变质的Na2SO3的纯度时,设计了如下三个方案:
方案一:取ag样品于小烧杯中,加入适量蒸馏水,搅拌,使之充分溶解,加入适量的4mol/L的盐酸,再加入足量的1mol/LBaCl2溶液,过滤、洗涤、烘干,称重为bg。
该同学所得纯度可能偏高的原因是 ,反应方程式为 ;
可能偏低的原因是 ;上述操作中沉淀如何洗涤? 。
方案二、取ag样品于蒸发皿中,用酒精灯慢慢加热,并用玻璃棒不停地搅拌,使之与空气充分接触,冷却后称量,重复以上步骤,直至质量基本不变,称重为bg。
该同学所得纯度可能偏高的原因是 ;可能偏低的原因 、 ;已知Na2SO3受热易分解为Na2SO4和Na2S,且被氧气氧化速度较慢,有什么改进的方法? ;如何称重才能保证误差最小? 。
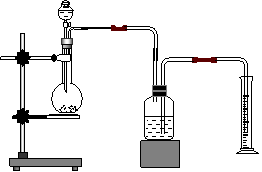 方案三、
方案三、
如图,(试剂瓶中所盛的是CCl4)连接好装置,检查气密性,装入ag样品后,滴入4mol/L盐酸,当量筒内液面高度不变时,读数为Vml(已折算成标准状况下)
该同学所得纯度可能偏高的原因是 ;可能偏低的原因是 、 ;考虑大气压的影响,读数时应怎样操作? ;滴加盐酸一段时间后,发现盐酸难以滴下,原因是 ,如何操作或改进? 。
四、(本题包括2小题,共分)
21.为了解决石油资源匮乏问题,世界各国正逐渐全面推广以乙醇、生物柴油等代替汽油、柴油、航空煤油。据中新网报道,巴西正生产一种号称全世界第一架不用燃油,而是以酒精为燃料的单引擎小飞机;我国也将全面推广使用车用乙醇汽油,它是以玉米、小麦、糖蜜为原料制造乙醇,再勾兑汽油制成。近日又提出发展生物柴油,即以大豆、油菜籽等油料作物,油粽、黄连木等油料林木果实,工程微藻等水生植物,以及动物油脂、废餐饮油等为原料制成的液体燃料。
阅读材料回答问题:
(1)下列说法正确的是 。
A.可以缓解石油供求矛盾,大大降低汽油价格
B.有利于调整产业结构,增加农民收入
C.能有效地降低汽车尾气中有害气体的排放量
D.乙醇、生物柴油是一种可再生能源
(2)写出由小麦(主要成分为淀粉)制乙醇的化学反应方程式:
① ,② ;
(3)掌握车用乙醇汽油的技术后,在推广车用乙醇汽油的过程中,你认为还应该解决哪些问题? 。
22.现代生活中,人们的健康意识在不断地增强,人们越来越注意微量元素的摄入。碘元素对人体健康与发育有着至关重要的作用,碘元素在人体中含量过高或过低都会有影响。为了预防碘缺乏病,我国规定每千克食盐中应含有40mg-50mg的碘酸钾。
回答下列问题:
(1)食盐包装袋通常标有如下建议:菜未熟不宜加入碘盐。请简述其中所包含的化学原理: 。
![]() (2)已知KIO3可用电解方法制得:以石墨为阳极,铁为阴极,在一定温度和电流强度下电解KI溶液。电解总反应方程式为:KI+3H2O KIO3+H2↑,则两极反应式分别为:阴极 ,阳极 。
(2)已知KIO3可用电解方法制得:以石墨为阳极,铁为阴极,在一定温度和电流强度下电解KI溶液。电解总反应方程式为:KI+3H2O KIO3+H2↑,则两极反应式分别为:阴极 ,阳极 。
(3)为检验某食盐中是否含有碘酸钾,某同学取食盐样品428g溶解后,加入盐酸酸化的淀粉—碘化钾溶液,溶液呈蓝色。反应的离子方程式为 ,其中氧化产物与还原产物的物质的量之比为 。
(4)为进一步确证该样品是否为合格产品,该同学再用0.030mol/L的硫代硫酸钠溶液滴定,当用去18.00mL时蓝色刚好又褪去。已知I2+2S2O32-=2I-+S4O62-,则可计算判断该加碘食盐为 (填“合格”或“不合格”)食盐。
五、(本题包括2小题,共分)
23.只含C、H、O的有机物,为便于研究其完全燃烧时反应物、生成物与所需氧气量的关系,可用通式(CnHm)x(H2O)y或(CnOm)x(H2O)y表示(m、n、x、y均为整数)。
(1)现有一类只含C、H、O的有机物,它们燃烧时消耗氧气和生成的二氧化碳的体积比为5:4,按照上述要求,该类化合物的通式可表示为 (写最简化的通式)。
(2)这类化合物中式量最小的物质的结构简式是 。
(3)这类化合物中生成的二氧化碳与水的物质的量之比为1:1,且能发生水解的物质的分子式为 ,该物质能发生水解的同分异构体有 种。
(4)若某一类有机物可用通式(CnOm)x(H2O)y表示,则在相同条件下,该类化合物完全燃烧时消耗氧气的体积V1和生成二氧化碳的体积V2必须满足的条件是 。
(5)现有一种有机物,它完全燃烧时消耗氧气和生成的二氧化碳的体积比为3:4,它具有两个羧基,其余的碳原子结合的原子或原子团都相同。取0.2625g该化合物恰好能与25.00mL 0.1000mol/L的NaOH溶液完全中和,由此可知该化合物的分子式为 ,结构简式为 。
24.葡萄糖是人体的营养元素。人体中在富氧条件下氧化生成二氧化碳和水,在缺氧时则生成一种有机酸A。已知将A进行如图所示的反应,其中C和C′是同系物,C′是甲酸(HCOOH)。回答下列问题:
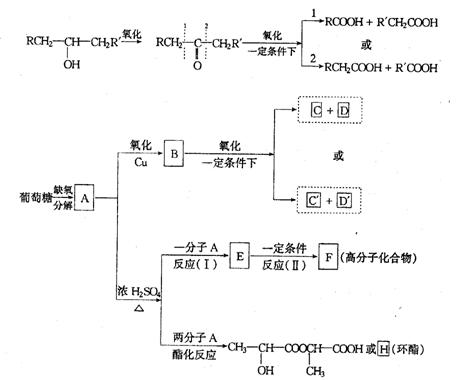
(1)C和D′属于 (用编号填入,下同)。
①同系物 ②同分异构体 ③同类物质 ④同素异形体
(2)D′和E分别属于哪一类化合物:D′ ,E 。
①多元酸 ②醛 ③不饱和羧酸 ④多元羧酸 ⑤酯
(3)写出结构简式:A ,F ,H 。
(4)写出反应类型:Ⅰ ,Ⅱ 。
(5)写出A→E的化学方程式: 。
六、(本题共分)
25.已知氧化性:Cl2>Br2>Fe3+。往500mL2.0mol/L的FeBr2溶液中通入amol氯气,试确定a不同取值时的离子方程式、氧化产物及其对应的物质的量,填入下表:
| a值的范围 | 有关离子方程式 | 氧化产物及其物质的量 |
| 0<a≤1/2 | ||
| 1/2<a≤3/2 | ||
| a≥3/2 |
26.向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。
请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同。试推断有几种可能的组成,填入下表(可不填满,也可补充):
| ① | ② | ③ | ④ | ⑤ | |
| 可能的组成 |
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g白色固体,请通过计算确定此白色固体是哪些物质组成,其质量各为多少?所用的KOH溶液的物质的量浓度为多少?