高考化学模拟试题(2)
可能用到的原子量:Mg = 24 O = 16 H = 1 S =32 K = 39
C = 12 Cl = 35.5 Ag = 108 Cr = 52 Na = 23 I=127 Cu=64
第一卷(共68分)
一、选择题:(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1.人的血液总是维持在PH=7.37~7.45范围内,这是由于
A.人体中有大量水分(占体重70%)
B.血液中氯化钠保持一定浓度
C.排出的二氧化碳溶解在血液中
D.血液中HCO3—和H2CO3的浓度稳定在一定范围内
2.法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性 B.该粒子质量数为4
C.在周期表中与氢元素占同一位置 D.该粒子质量比氢原子大
3.苹果汁是人们喜爱的饮料,由于其中含有亚铁离子,在榨取后不久往往会变为棕黄色,生产上常在其中加入维生素C以防止其变色,这是利用了维生素C的
A.氧化性 B.还原性 C.酸性 D.碱性
4.将SO2通入BaCl2溶液至饱和未见沉淀,继续通入另一气体仍无沉淀,通入的气体可能是
A.CO2 B.NH3 C.NO2 D.H2S
5.航天科学技术测得,三氧化二碳(C2O3)是金星大气层的成分之一。下列有关C2O3的说法正确的是
A.C2O3和CO2是同素异形体 B.C2O3和CO燃烧产物都是CO2
C.C2O3和CO都是酸性氧化物 D.C2O3和CO2都是碳酸的酸酐
6.室温下,某溶液中水电离出来的H+和OH-浓度的乘积为1×10-24,该溶液中一定不能大量存在的离子是
A.S2O32- B.NH4+ C.NO3- D.HCO3-
![]()
![]()
|
|
符合图b的是
|
|
|
|
B.Ba(OH)2•8H2O与NH4Cl反应
C.盐酸和金属铝反应
D.金属钾与水反应
8.过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强的氧化性和腐蚀性,他可由冰醋酸与过氧化氢在一定条件下制得;他可以迅速杀灭多种微生物,包括多种病毒(如:SARS病毒)、细菌、真菌及芽孢,有关过氧乙酸的叙述正确的是
A.过氧乙酸与羟基乙酸(HOCH2COOH)互为同分异构体
B.过氧乙酸可与苯酚混合使用
C.由过氧化氢与醋酸制取过氧乙酸的反应属于氧化还原反应
D.浓过氧乙酸中加入少许紫色石蕊试液,振荡后试液一定呈红色
二、选择题:(本题包括11小题,每小题4分,共44分。每小题有一个或两个选项符题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题为0分。)
9.76.8 mg Cu与足量浓硝酸反应,铜全部作用,如果NO3-减少2×10-3mol,则溶液中H+同时减少
A.4.8×10-3mol B.4.4×10-3mol C.3.2×10-3mol D.2.2×10-3mol
10.维生素E在国外美称之“生命奇迹丸”,是一种脂溶性维生素,对抗衰老等有特殊作用,经研究发现维生素E有α、β、γ、δ四种类型,其结构简式如下:上述互为同分异构体的是
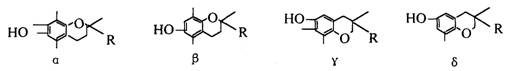
其中R为-CH2CH2CH2[CH(CH3)CH2CH2]2CH(CH3)2即:

A.α β B.β γ C.γδ D.α δ
11.某温度下,在一容积可变的容器中,反应2A(s)十B(g)![]() 2C(g);△H>0,达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,当采取下列措施能使平衡向正反应方向移动的是
2C(g);△H>0,达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol,当采取下列措施能使平衡向正反应方向移动的是
A.升高温度 B.加入催化效果更好的催化剂
C.A、B、C均增加1mol D.A、B、C的量均减半
12.下列离子反应方程式正确的是
A.氯气与水反应:Cl2 +H2O =Cl-+2H++ClO-
B.氨气通入醋酸溶液中NH3+H+=NH4+
C.氯化铁溶液显弱酸性:Fe3++3H2O![]() Fe(OH)3
+3H+
Fe(OH)3
+3H+
D.碳酸氢钠溶液中加入过量石灰水HCO3-+OH-=CO32-+H2O
13.X和Y两元素的阳离子具有相同的电子层结构。X元素的阳离子半径大于Y元素的阳离子半径。Z和Y两元素的核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。则X、Y、Z三种元素原子序数的关系是
A.X>Y>Z B.Y>X> Z C.Z>X>Y D.Z>Y>X
14.以NA表示阿伏加德罗常数,下列说法正确的是
A.0.1molH3O+中含有NA个电子
B.标准状况下,11.2L臭氧中含有NA个氧原子![]()
C.2g重氧水(H218O)、含有NA个中子
D.84gNaHCO3晶体中含有NA个CO32—
15.经测定某溶液中只含NH4+、C1- 、H+、OH-四种离子,下列说法错误的是
A.溶液中四种粒子之间不可能满足:c(C1-)>c(H+)>c(NH4+)>c(OH-)
B.若溶液中粒子间满足:c(NH4+)>c(C1-)>c(OH-)>c(H+)则溶液中溶质一定为:NH4Cl和NH3·H20
C.若溶液中粒子间满足:c(C1-)>c(NH4+)>c(H+)>c(OH-)溶液中溶质一定只有NH4Cl
D.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
16.已知热化学反应方程式:
2H2(气)+O2(气)=2H2O(液);ΔH=-571.6KJ,
2H2O(气)=2H2(气)+O2(气);ΔH=+483.6KJ。
则下列说法正确的是
A.每摩尔水气化时所吸收的热量是88.0KJ
B.水由液态变气态是一个吸热反应
C.1g氢气燃烧生成气态水可放出120.9KJ热量
D.若将1mol液态水加热分解为氢气和氧气,至少要吸收285.8KJ热量
17.下列说法正确的是
A.强碱与弱酸所生成的盐,其水溶液一定呈碱性
B.离子晶体中可能含有共价键,分子晶体中不一定含有共价键
C.一切四面体空间构型的分子内键角均为109°28′
D.金属氧化物一定是碱性氧化物
18.已知95%(溶质的质量分数)酒精溶液的物质的量浓度为16.52mol/L,试判断47.5%酒精溶液的物质的量浓度为
A.大于8.26mol/L B.等于8.26mol/L
C.小于8.26mol/L D.无法判断
19.下列关于胶体的认识错误的是
A.鸡蛋清溶液中加入饱和(NH4)2SO4溶液生成白色沉淀,属于化学变化
B.将一束强光通过淀粉溶液,也能产生丁达尔现象
C.水泥厂、冶金厂常用高压电除去烟尘,是因为烟尘微粒带电荷
D.纳米材料微粒直径一般从几纳米到几十纳米(1nm=10-9m ),因此纳米材料属于胶体
第Ⅱ卷(共82分)
 三.(本题有二小题共22分)
三.(本题有二小题共22分)
|
|
|
①O2 ②H2 ③Cl2 ④CO2 ⑤HCl ⑥NO ⑦H2S
21.(16分)“套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验.因其具有许多优点,近年被广泛开发并应用于化学实验中.下述两个实验均为“套管实验”,请观察图31-6的实验装置、分析实验原理,回答下列问题:
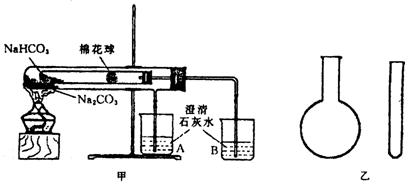 图31-6
图31-6
实验一:如图甲,小试管内塞有沾有无水硫酸铜粉末的棉花球.
(1)从点燃酒精灯开始,棉花球及烧杯A、B中能观察到的现象有_________________
(2)整个实验结束时,在操作上需要特别注意的问题是___________
(3)通过该实验可以得出的结论是
实验二:在氨气的喷泉实验中,将圆底烧瓶集满氨气的操作很麻烦.请设计一个简单的操作方法,只用一支试管(如图乙),选用下列药品:A.氯化铵固体;B.氢氧化钠固体;C.浓氨水;D.浓硫酸;E.湿润的红色石蕊试纸,采用“套管法”在圆底烧瓶中集满喷泉实验所用氨气.
(4)所用的试剂为:_________________________.(填序号)
(5)请简述所设计的操作及判定收集满氨气的现象:____________
(6)产生氨气的化学反应方程式为:
(7)将上述两个实验与普通实验相比较,“套管实验”明显具备的优点是:
四.(本题有2小题共20分)
22.(8分)25℃时,将a mol CH3COOH和b mol NaOH溶于水,形成1L混合溶液。
(1) 该溶液中存在的平衡体系有:
(2)混合溶液的pH (填编号)
①大于7 ②小于7 ③等于7 ④无法确定
(3)若混合溶液中c(Na+)=c(CH3COO—),则混合溶液的pH是
其原因是
23. (12分)已知:D.E.F.K.L为气体,E能使澄清石灰水变浑浊,I是金属,1molA在反应①中转移的电子的物质的量为1mol,B.H是常见的化肥,它们有如下图所示转化关系(部分反应中生成的水已略去):试回答下列:
(1) 写出化学式;C_______ D ________ H ______ N ________
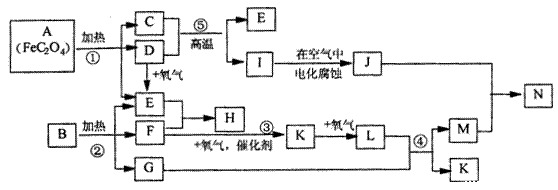 |
(2)写出反应方程式②____________ ③ _____________④ _________
(3)写出离子反应方程式 I+M—N+K:___________________
![]() 五.(本题包括2小题,共18分)
五.(本题包括2小题,共18分)
24.(10分)吡咯 的性质与苯酚相似,N原子使邻位氢原子
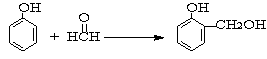 反应活性增强。已知1mol苯酚与1mol甲醛反应如下:
反应活性增强。已知1mol苯酚与1mol甲醛反应如下:
(1)吡咯和甲醛在一定条件下反应生成导电性能优良的高聚物,请写出以它们为原料合成该高聚物的化学方程式:
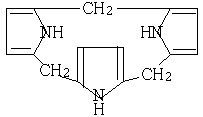
(2)吡咯在有机溶剂中跟甲醛反应首先可能生成化合物M(分子式为C5H7ON)然后生成少量的化合物N(分子式为C15H15N3)则M、N的结构简式分别为:M N
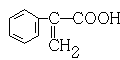
(3)某有机物化学式为C9H8O2经测定分子中含有苯环,并具有下列性质:①能与NaOH溶液发生中和反应②能与乙醇发生酯化反应③能使溴水褪色。写出该有机物可能的结构简式(苯环上含有两个取代基的有机物只要求写一种)
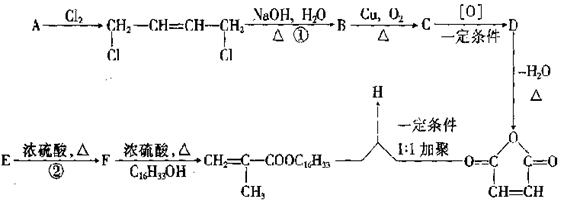
25.(8分) 降凝剂H可以降低油品的凝固点,它是一种高分子聚合物,其合成路线可以设计如下:
|
请回答下列问题:
(1)指出反应类型:① ,② 。
(2)写出结构简式:D , H 。
(3)写出E→F的化学方程式: 。
六.(本题包括2小题,共20分)
26.(10分)有一小块表面被空气缓慢氧化的金属钠,质量为0.292g.将它投入水中,在标准状况下产生112mL气体,生成的25℃的溶液120 mL,试求: (1)原金属钠的质量 (2)溶液的pH值.
27(10分)在隔绝空气的条件下,加热由1mol CuO粉末和a mol炭粉组成的混合物,当a不同的取值范围时,可能发生下面一种或两种反应:① CuO+C=Cu+CO↑②2CuO+C=2Cu+CO2↑反应完全后,冷却并排走气体,所得到的残留固体的组成也不相同。请确定不同情况时a的取值范围、残留固体中各组分的物质的量或发生的化学反应,
将结果填在下表空格。
| a的取值范围 | 发生的化学反应的序号 | 残留固体物质的量 | |||
| CuO | Cu | C | |||
| 1 | ① | 0 | |||
| 2 | 0 | ||||
| 3 | 0 | 0 | |||
参考答案
1D、2C、3B、4A、5B、6D、7B、8A
9B、10B、11AC、12C、13D、14AC、15AC、16CD、17B、18A、19D
20.②④⑦、②、2Al+2OH—+2H2O=2AlO—+3H2↑
21. (1)棉花球变蓝;刚加热时A中导管有气泡冒出一会儿停,无浑浊出现;B中持续出现气泡,溶液变白色浑浊
(2)停止加热前,先移出石灰水中导管
(3)![]() 热稳定性大于
热稳定性大于![]() ,
,![]() 受热分解,有
受热分解,有![]() 和水生成
和水生成
(4)B、C
(5)倒置烧瓶;在小试管内装入所需药品,迅速将试管伸进烧瓶中,并将试管口靠近烧瓶底;一会儿,将E伸近烧瓶口,若变蓝,则已集满![]()
(6)![]()
(7)操作简单,实验效率高,现象明显,试剂节约
22.(1)H2O![]() H++OH—、CH3COOH
H++OH—、CH3COOH![]() CH3COO—+H+
CH3COO—+H+
CH3COO—+ H2O![]() CH3COOH+OH—
CH3COOH+OH—
(2)④
(3)7、c(H+)+c(Na+)=c(OH—)+c(CH3COO—)因c(Na+)=c(CH3COO—)故c(H+)=c(OH—),25℃时pH=7
23(1)FeO;CO;CO(NH2)2;Fe(NO3)2,或Fe(NO3)2
(2)NH4HCO3 =NH3↑+H2O+CO2↑或(NH4)2CO3 =2NH3↑+H2O +CO2↑
4NH3 + 5O2 = 4NO + 6H2O、3NO2 + H2O = 2HNO3 + NO
(3)Fe+4H++NO3-=Fe3++NO↑+2H
24.(1)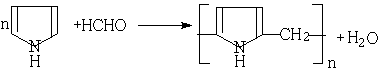
(2)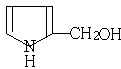 、
、
(3)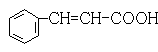 、
、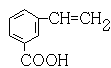 、
、
25.(1)取代、消去
(2)HOOCCH=CHCOOH、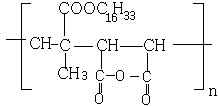
![]() (3)(CH3)2COHCOOH CH2=C(CH3)COOH+H2O
(3)(CH3)2COHCOOH CH2=C(CH3)COOH+H2O
26.(1)0.276g(2)13
27
| a的取值范围 | 发生的化学反应的序号 | 残留固体物质的量 | |||
| CuO | Cu | C | |||
| 1 | a≥1 | ① | 0 | 1 | a-1 |
| 2 | 0<a≤0.5 | ② | 1-2a | 2a | 0 |
| 3 | 0.5<a<1 | ①② | 0 | 1 | 0 |