高考化学热点回眸2
1.以![]() 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
A 0.1 mol H3O+中含有![]() 个电子 B标准状况下,11.2L臭氧中含有
个电子 B标准状况下,11.2L臭氧中含有![]() 个氧原子
个氧原子![]()
C 2g重氧水(H218O)含有![]() 个中子 D 84gNaHC03晶体中含有
个中子 D 84gNaHC03晶体中含有![]() 个CO32-
个CO32-
2.由短周期元素形成化合物A2B3,A3+比B2-少一个电子层,且A3+具有与Ne相同的核外电子层结构,则下列说法正确的是 ( )
A.A2B3是三氧化二铝 B.A3+和B2-最外层上的电子数相等
C.A是第2周期第IIIA族的元素 D.B是第3周期IVA族的元素
3.一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是 ( )
2NH3(g)达到化学平衡状态的标志是 ( )
A.c(N2)∶c(H2)∶c(NH3)=1∶3∶2
B.N2,H2和NH3的物质分数不再改变
C.N2与H2的物质的量之和是NH3的物质的量2倍
D.单位时间里每增加1molN2,同时增加3molH2
4.下列离子方程式正确的是
A 明矾溶液中加放过量的氨水
Al3++4OH-==== AlO2-+2H2O
B 漂白粉溶液中通入过量的二氧化碳
Ca2++2ClO-+CO2+H2O====CaCO3↓+2HClO+CO32-
C FeBr2溶液中加入过量的氯水
2Br-+Cl2====Br2+2Cl-
D 澄清的石灰水中加入过量的NaHCO3溶液:
Ca2++2OH-+2HCO3-====CaCO3↓+2H2O+CO32-
5.已知20oC时,CuSO4的溶解度为20g。此温度下将36g的无水硫酸铜放入100g水中,
充分搅拌后,所得溶液的质量约为
A.136 g B.120g C.116g D.108g
6.在元素周期表短周期中的X和Y两种元素可组成化合物XY3,下列说法正确的是
A.XY3晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数可能是m±4
C.X和Y可属于同一周期,也可属于两个不同周期
D.X和Y一定不属于同一主族
7.化合物A、B、C都只含有两种元素,且A、B均含X元素。已知一定条件下可发生反应:A+B——X+C,X是一种单质,由此可知X元素( )
A、一定是金属元素
B、一定是非金属元素
C、可能是金属元素,也可能是非金属元素 D、无法确定
8.在一定条件下,氯酸钾与碘发往反应KClO3+I2=2KIO3+Cl2。下列相应的结论中,不正确的是( )
A.该反应属置换反应 B.还原性:I2>Cl2
C.非金属性:I2>Cl2 D.氧化性:KClO3>I2
9.下列离子方程式中正确的是
A.过量的NaHSO4与Ba(OH)2溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
B.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3↑+H2O
C.苯酚钠溶液中通入少量CO2:![]() -O-+CO2+H2O→
-O-+CO2+H2O→![]() -OH+HCO3-
-OH+HCO3-
D.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl-=2Fe3++Br2+4Cl-
10.沼气是一种能源,它的主要成分是CH4。 0.5mol CH4完全燃烧生成CO2和H2O时,
放出445kJ热量,则下列热化学方程式中正确的是 ( )
A、2 CH4(g)+4 O2(g)===2 CO2(g)+4 H2O(l) ; △H=+890kJ·mol-1
B、CH4(g)+2 O2(g)===CO2(g)+2 H2O(l) ; △H=+890kJ·mol-1
C、CH4(g)+2 O2(g)===CO2(g)+2 H2O(l) ; △H=-890kJ·mol-1
D、1/2 CH4(g)+ O2(g)===1/2CO2(g)+ H2O(l) ; △H=-890kJ·mol-1
11.某主族元素的离子X2+有6个电子层,最外层有2个电子,当把XO2溶于浓盐酸时,有黄绿色气体产生,则下列说法正确的是 ( )
A.X2+具有强还原性 B.XCl2溶液呈酸性 C.XO2具有强氧化性 D.该元素是ⅡA族
12.有4种有机物:①![]() ②
②![]() ③
③![]() ④CH3-CH=CH-CN,其中
④CH3-CH=CH-CN,其中
可用于合成结构简式为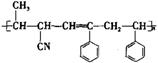 的高分子材料的正确组合为
的高分子材料的正确组合为
A.①③④ B.①②③ C.①②④ D.②③④
13.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol电子,锌的质量理论上减小6.5g
14.酸碱中和反应属于放热反应,酸碱中和生成1mol水时所放出的热量称为中和热。放下列浓度均为0.1mol/L的溶液混合时,相关说法中正确的是
A.与NaOH反应时,HCL的中和热小于CH3COOH的中和热
B.与NaOH反应时,HCL的中和热大于CH3COOH的中和热
C.与NaOH反应时,H2SO4的中和热大于HCL的中和热
D.与H2SO4反应时,Ba(OH)2的中和热等于NaOH的中和热的2倍
15.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是 ( )
A.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次
B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
C.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度
D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
16.与醛基相邻的碳原子上的氢原子叫a—H,无a—H的醛在强碱作用下,发生分子间氧化—还原反应生成酸和醇,叫做康尼查罗反应,例如![]()
![]() ,则下列化合物中不发生康尼查罗反应的是( )
,则下列化合物中不发生康尼查罗反应的是( )
①![]() ②
②![]() ③
③![]() ④
④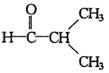
A.①② B.①②④ C.③④ D.①②③④
17.铝、铍(Be)及其化合物具有相似的化学性质,如其氯化物分子内键型相同,故其氯化物晶体的熔点都较低。已知反应:BeCl2+Na2BeO2+2H2O=2NaCl+2Be(OH)2↓能完全进行,则下列推断正确的是
A.Na2BeO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为BeO
B.BeCl2溶液的pH<7,将其蒸干并灼烧后得到的残留物可能是BeO
C.Be(OH)2既能溶于盐酸,又能溶于NaOH溶液
D.BeCl2水溶液的导电性强,故BeCl2是离子化合物
18.化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学
键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P—P 198KJ·mol—1、P—O 360kJ·mol—1、氧气分子内氧原子间的键能为
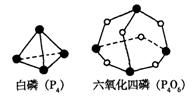 498kJ·mol—1则P4+3O2==P4O6的反应热△H为
498kJ·mol—1则P4+3O2==P4O6的反应热△H为
A.+1638 kJ·mol—1 B.一1638 kJ·mol—1
C.一126 kJ·mol—1 D.十126 kJ·mol—1
19.(12分)某校研究性学习小组设计实验测定电石样品的纯度。
经查阅有关资料得知:H2S、PH3与硫酸铜溶液反应的化学方程式分别是
H2S+CuSO4==CuS↓+H2SO4 ;19PH3+56CuSO4+44H2O==11H3PO4+56H2SO4+32Cu↓+8Cu3P↓。
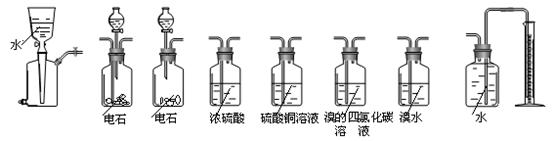 相关仪器和药品装置图如下:
相关仪器和药品装置图如下:
A B C D E F G H
请你参与活动并就下列问题发表你的见解:
⑴按气体从左到右的流向选择合理的装置组合是(选填字母序号):
⑵经小组同学讨论认为乙炔的吸收装置选用F装置最佳。理由是:
⑶为保证测定的精度,要求产生乙炔的气流较为平缓,在分液漏斗中应装入的液体是 。
⑷若电石样品的质量为m1 g,F吸收乙炔前后的质量差为m2 g,则电石样品中CaC2质量分数ω(CaC2)= 。
20.(12分)(1)如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液中由水电离出的c(H+)_____________0.1mol/LNaOH溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合物中下列算式的精确计算结果(填具体数字):
![]()
![]()
(2)在含有A-、Na+、H+、OH-的水溶液中,如果出现下列关系,请将它们在溶液中可能对应的溶质分别填入横线上。
![]()
![]()
![]()