高考化学最后精选题
一、选择题(每小题只有一个选项符合题意)
1.设NA为阿伏加德罗常数,下列叙述正确的是
A.常温常压下,11.2L甲烷含有的分子数为0.5NA
B.常温常压下,12g C60中含有的碳原子数为NA
C.在1L 1mol/L的NH4Cl溶液中,NH4+与Cl—离子总数为2NA
D.将标准状况下44.8LNO2充入一密闭容器中,充分反应后生成N2O4的分子数为NA
2.法国科学家最近发现了一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子说法不正确的是
A.该粒子不显电性 B.该粒子质量数为4
C.在周期表中它与氢元素占有一位置 D.该粒子质量比氢原子大
3.用下列三种装置制备和收集CO2:
 | |||
 | |||
(1) (2) (3)
将收集到的三瓶CO2置于天平上称量,若三个集气瓶体积相同、质量相等,则称量结果正确的是
A. (2)最轻,(3)最重 B. (1)(2)(3)一样重 C. (1)最重,(3)最轻 D. (2)最重,(3)最轻
4.a、b、c、d是四种短周期元素,a、b、d同周期,c、d同主族。a的原子结构示意图为
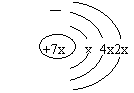
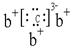 |
,b和c形成化合物的电子式为 ,
下列比较正确的是
A. 原子半径a >b >c B. 原子的氧化性a > c > b
C. 最高价氧化物的熔点a > d > b D. 最高价含氧酸的酸性c > d > a
5.向含有等物质的量的HCl、Al2(SO4)3、NH4Cl的混合液中逐滴加入稀NaOH溶液至过量
(不断振荡反应容器),整个过程中会发生如下四个离子反应:
① Al3+ + 3OH-=== Al(OH)3↓ ② Al(OH)3 + OH-=== AlO2- + 2H2O
③ H+ + OH-=== H2O ④ NH4+ + OH-=== NH3·H2O 反应的先后顺序是
 A. ③④①② B. ③①④② C. ③①②④
D. ①②③④
A. ③④①② B. ③①④② C. ③①②④
D. ①②③④
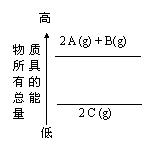
6.分析右面的能量变化示意图,下列热化学方程式正确的是
A.2A(g) + B(g)==2C(g);△H= a(a>0)
B.2A(g) + B(g)==2C(g);△H = a (a<0)
C.2A + B==2C;△H = a (a<0)
D.2C==2 A +B;△H = a(a>0)
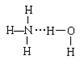
7. 氨气溶于水时,大部分NH3与H2O以氢键(用“··· ”表示)结合形成NH3·H2O分子。根据氨水的性质可推知NH3·H2O的结构式为
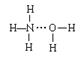 |  | ||
![]()
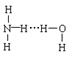 A.
B. C.
D.
A.
B. C.
D.
8.下列分子中所代表的有机物中,肯定不溶于水,且原因是不能与水分子形成氢键的是
A.C2H6O B.C2H4O2 C.C6H5Br D.C3H7NO2
9.下列可用氢键来解释的是
A.浓的氢氟酸溶液中存在HF2-和H2F3- B.SiH4沸点比CH4高
C.水和乙醇分别与金属钠反应,前者比后者剧烈
D.H2O比H2S稳定,前者1000oC以上才分解,后者300 oC分解
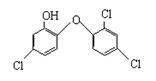 10.英国媒体05年4月15日报道,高露洁牙膏中含有的消毒剂三氯生,遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至导致癌症。已知三氯生的结构简式如下:有关说法不正确的是
10.英国媒体05年4月15日报道,高露洁牙膏中含有的消毒剂三氯生,遇含氯自来水能生成哥罗芳(三氯甲烷),哥罗芳能导致肝病甚至导致癌症。已知三氯生的结构简式如下:有关说法不正确的是
A.三氯生的分子式为C12H7Cl3O2
B.哥罗芳不存在同分异构体
C.三氯生能与氢氧化钠溶液反应 D.三氯生易溶于水
11.简单原子的原子结构可用下图形象地表示:
![]()
其中![]() 表示质子或电子,
表示质子或电子,![]() 表示中子,则下列有关①②③的叙述正确的是
表示中子,则下列有关①②③的叙述正确的是
A.①②③互为同位素 B.①②③为同素异形体
C.①②③是三种化学性质不同的粒子 D.①②③具有相同的质量数
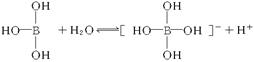
12.某些电解质分子的中心原子最外层电子未达饱和结构,其电离采取结合溶液中其他离子的形式,而使中心原子最外层电子达到饱和结构。例如:硼酸分子的中心原子B最外层电子并未达到饱和,它在水中的电离过程为:
|
下列判断正确的是
A.凡是酸或碱对水的电离都是抑制的 B.硼酸是三元酸
C.硼酸溶液与NaOH溶液反应的离子方程式为:H3BO3+OH-===[B(OH)4]-
D.硼酸是两性化合物
13.下列各组物质的分类正确的是
A.同位素:1H、2H+、3H— B.非电解质:Cl2、NH3、C2H5OH
C.同系物: ![]() -OH、CH3-
-OH、CH3-![]() -OH、CH3-
-OH、CH3-![]() -CH2OH
-CH2OH
D.非极性分子:C60、CO2、CCl4
14.航天科学技术测得,三氧化二碳(C2O3)是金星大气层的成分之一。下列有关C2O3的说法正确的是
A.C2O3和CO2是同素异形体 B.C2O3和CO燃烧产物都是CO2
C.C2O3和CO都是酸性氧化物 D.C2O3和CO2都是碳酸的酸酐
15.下列各组离子在溶液中能大量共存的,且此溶液既能与盐酸反应又能与烧碱反应的是
A.Na+、K+、SO42-、CO32- B.AlO2-、OH-、Na+、K+
C.Fe2+、NH4+、NO3-、Cl- D.NH4+、Fe2+、HSO4-、OH-
16.本题列举的四个选项是4位同学在学习“化学反应的速率和化学平衡”一章后,联系工业生产实际所发表的观点,你认为不正确的是
A.化学反应速率理论是研究怎样在一定时间内快出产品
B.化学平衡理论是研究怎样使用有限原料多出产品
C.化学反应速率理论是研究怎样提高原料转化率
D.化学平衡理论是研究怎样使原料尽可能多地转化为产品
17. 消毒剂是印度洋沿岸防止大规模瘟疫的急需物品,来自全世界的大量消毒剂被紧急运送到灾区,但一些消毒剂是不能同时混用的,据报道,在灾区发生过多次因混合洁污剂而引起氯气中毒事件,据此推测,相混合的洁污剂中最有可能含有
A.ClO3-、Cl-、H+ B.ClO-、Cl-、H+ C.NaClO、NaClO3 D.NaClO、NaCl
18.1L1.00mol·L-1的纯碱溶液逐滴加入到1L1.25mol·L-1的盐酸中;再做相反操作:将1L1.25mol·L-1的盐酸逐滴加入到1L1.00mol·L-1的纯碱溶液中,两次操作在同温同压下产生气体的体积比是
A.2:5 B.1:1 C.2:1 D.5:2
19.食品安全是近期的焦点问题。苏丹红是一种工业合成染色剂,但却被滥用作食品的着色剂,严重危害了人们的身体健康。苏丹红1(sudan 1)
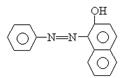 的结构简式如下图,有关它的叙述不正确的是
的结构简式如下图,有关它的叙述不正确的是
A.可与FeCl3溶液发生显色反应
B.1mol该物质可与1mol Br2发生取代反应
C.其分子式为C16H12N2O D.该物质极易溶于水
![]() 20.一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:
20.一定温度下,向容积恒定的密闭容器中投入2molA和1molB,发生如下可逆反应:
![]() 2A(g)+B(g) C(g)+D(s)。达到平衡时,测得压强为原压强的—。则A的转化率为
2A(g)+B(g) C(g)+D(s)。达到平衡时,测得压强为原压强的—。则A的转化率为
A.25% B.40% C.50% D.75%
21.下列反应的离子方程式不正确的是
![]() A.醋酸加入氨水:CH3COOH+NH3·H2O CH3COO-+NH4++H2O
A.醋酸加入氨水:CH3COOH+NH3·H2O CH3COO-+NH4++H2O
B.足量氯气通入碘化亚铁溶液中:Cl2+Fe2++2I- 2Cl-+Fe2++I2
C.氢氧化镁加入醋酸:Mg(OH)2+2CH3COOH Mg2++2CH3COO-+2H2O
D.硫氰化钾溶液加入三氯化铁溶液:Fe3++SCN- [Fe(SCN)]2+
22.下列各组离子:
(1)I-、ClO-、NO3-、H+ (2)K+、NH4+、HCO3-、OH-
(3)SO32-、SO42-、Cl-、OH- (4)Fe3+、Cu2+、SO42-、Cl-
(5)H+、K+、AlO2-、HSO3- (6)Ca2+、Na+、SO42-、CO32-
在水溶液中能大量共存的是
A.(1)和(6) B.(3)和(4) C.(2)和(5) D.(1)和(4)
23.物质的量浓度相同的下列溶液: ①Na2CO3 ②NaHCO3 ③H2CO3 ④(NH4)2CO3
⑤NH4HCO3,按[CO32-]由小到大排列顺序是
A.⑤<④<③<②<① B.③<⑤<②<④<①
C.③<②<⑤<④<① D.③<⑤<④<②<①
24.蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下式是爱迪生蓄电池分别在充电和放电时发生的反应:
![]()
下列有关对爱迪生蓄电池的推断错误的是
A.放电时,Fe是负极,NiO2是正极
B.充电时,阴极上的电极反应式为: Fe(OH)2+2e-==Fe+2OH-
C.放电时电解质溶液中的阴离子是向正极方向移动
D.蓄电池的电极必须浸入碱性电解质溶液中
25.2004年10月13日有关媒体报道天津巨能化学有限公司生产的巨能钙含有双氧水,经农业部产品质量监督检验测试中心检测,部分送检品种不同程度地含双氧水。双氧水属于危险化学品及有毒有害物质,以前也曾作为漂白剂、杀菌剂、防腐剂广泛用于食品中。下列有关H2O2的叙述中正确的是
A.H2O2是二元弱酸,将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失,一定是
因为发生了酸碱中和反应
B.H2O2分子中含有非极性键,因此H2O2是非极性分子
C.H2O2的自然分解过程非常缓慢,一般不易察觉,但正因为如此,一般药用的双氧水
在贮存期间也会逐渐失效
D.人体中含有过氧化氢酶,过氧化氢酶可以使H2O2分解,因此人体即使吸收多量的
H2O2也没有关系,可以被过氧化氢酶分解为无毒物质
二、(本题包括3小题)
26.已知:[Ag(NH3)2]++2H+==Ag++2NH4+。今有一白色固体,可能由K2SO4、Al2(SO4)3、AgNO3、BaCl2、NH4Cl、KOH中的2种或3种组成。为确定该白色固体组成,进行了以下实验:取白色固体少许,加入适量蒸馏水充分振荡,得到无色透明溶液,取少许无色透明溶液,滴加适量稀硝酸,有白色沉淀生成。
(1)按此白色固体肯定含有的物质来分析,有两种可能:
①若肯定含有的物质为2种,它们是______________________________________。
②若肯定含有的物质为3种,它们是______________________________________。
|
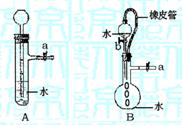
27.根据下图及描述,回答下列问题:
(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管
里注入一定量的水,静置如图所示。试判断:
A装置是否漏气?(填“漏气”、“不漏气”或“无
法确定”) 。判断理由: 。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不
断往下滴,直到全部流入烧瓶。试判断:B装置是
否漏气?(填“漏气”、“不漏气”或“无法确定”) 。
判断理由: 。
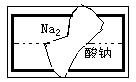 (3)某中学学习小组在帮助老师整理实验室的化学试剂时,发现一
(3)某中学学习小组在帮助老师整理实验室的化学试剂时,发现一
盛有无色溶液的试剂瓶,标签破损(如右图),请你根据已掌握
的知识,对该试剂可能是什么物质的溶液作出猜想,并设计实
验验证。
①猜想:这种试剂可能是:_____________________
②实验验证: _____________________________
28.实验室测定CuSO4·nH2O晶体的n值,实验操作步骤如下:
①称得干燥的容器甲质量为m1g;
②往容器甲中加入CuSO4·nH2O晶体后,称得容器甲与晶体的总质量为m2g;
③加热容器甲至晶体变白,不再有水蒸气逸出时,立即放入干燥器内冷却至常温,再称量容器甲与固体的总质量;
④重复步骤③至两次称量结果的误差小于0.1g,记录所称得容器甲与无水CuSO4的总质量为m3g。
(1)容器甲应选 (填选项的标号)
A.蒸发皿 B.烧杯 C.坩埚 D.试管
(2)步骤④的目的是 。
(3)实验结果,n= (用含m1、m2、m3的代数式表示)。
(4)不能用上述方法测定下列晶体的n值,请简述理由:
①FeCl3·nH2O ;
②FeSO4·nH2O 。
三、(本题包括2小题)
29.A、B、C、D、E是五种短周期元素,原子序数依次增大。前四种的原子序数之和是E的原子序数的二倍。E的阳离子与D的阴离子都比A阳离子多2个电子层。D与四种元素中任意一种都可形成原子个数比不相同的若干种化合物。B是形成化合物种类最多的元素。请回答下列问题:
(1)写出元素符号:A ,E 。
(2)D在周期表中位于第 周期第 族。
(3)五种元素原子半径由大到小的顺序是(用A~E字母表示) 。
(4)A、B、C、D可形成一种受热易分解的化合物,写出该化合物受热分解的化学方程式 。
(5)A、B、D可形成A2B2D4型化合物,该化合物的名称是 。
30.将固体FeC2O4·2H2O放在一个可称量的容器中加热灼烧,固体质量随温度升高而变化,测得数据如下:
| 温度/℃ | 25 | 300 | 350 | 400 | 500 | 600 | 900 |
| 固体质量/g | 1.000 | 0.800 | 0.800 | 0.400 | 0.444 | 0.444 | 0.429 |
根据计算分析推理,完成下列填空:
(1)写出25℃~300℃时固体发生变化的化学方程式______________________________,
判断理由是_______________________________________________________。
(2)250℃~400℃时发生变化得到的产物是_______________________________________,
物质的量之比为___________________________。
(3)500℃时产物的含氧质量分数为_____________________________。
(4)写出600℃~900℃时发生变化的化学方程式_____________________________。
四、(本题包括2小题)
31.有机物A与乙酸无论以何种比例混合,只要质量一定,完全燃烧后产生的水的质量也一定,试回答:
⑴若A与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则A的结构简式为_____________。
⑵若A有四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则A的结构简式为_____________。
⑶若A分子中C、H元素质量分数之和为86.67%,其余为O,且A的相对分子质量小于200,则A的分子式为___________。如果A分子每个碳原子都达到饱和,且能与金属钠反应产生氢气,则A的结构简式为________________________。
![]() 32.按下图所示步骤以不饱和烃A为原料合成
:
32.按下图所示步骤以不饱和烃A为原料合成
:
![]()
![]()
A(CH2=CH—CH=CH2) B C
![]()
![]()
![]()
![]() F
G
F
G
![]()
![]()
![]()
![]()
H I J[(C4H2O3)n]
已知:
①CH2=CH—CH=CH2和Br2按1:1反应,生成CH2Br—CHBr—CH=CH2或
![]() CH2Br—CH=CH—CH2Br ;
CH2Br—CH=CH—CH2Br ;
![]() ②
②![]() (不稳定)
;
(不稳定)
;
![]() ③
③
+ + H2O
(1)写出结构简式:B ,F 。
(2)①~⑨中属于加成反应的有 (填序号)。
(3)写出②、⑤、⑧步的化学方程式:
②
⑤
⑧
(4)在上述合成路线中,有人提议略去③④⑤⑥,由C直接制H,是否合理 ,
理由是 。
![]() (5)在上述合成路线中,又有人提议由H直接制
,是否合理
,
(5)在上述合成路线中,又有人提议由H直接制
,是否合理
,
理由是 。
五、(本题包括3小题)
33.某结晶水合物,含有两种阳离子和一种阴离子,其中所含元素均为短周期元素。为确定其
组成,有同学进行了如下实验:
称取9.06 g样品,溶于水,将溶液分成两等份,待用。
①向一份溶液中逐滴加入6mol·L-1 NaOH溶液,先观察到有白色沉淀产生,而后产生使湿润的红色石蕊试纸变蓝色的气体,继续滴加NaOH,白色沉淀又逐渐消失,最后得到无色透明溶液。向其中加入足量BaCl2溶液,可得不溶于稀盐酸的白色沉淀4.66 g。
②取另一份溶液,加入足量6mol· L-1NaOH溶液,加热,收集到标准状况下的气体224 mL。然后,往溶液中通入足量CO2,过滤,将所得沉淀洗涤、烘干、灼烧,得白色固体0.51 g。
请回答:
(1)该结晶水合物中含有的两种阳离子是 、 ;一种阴离子是 。
(2)试通过计算确定该结晶水合物的化学式,请写出计算过程。
34.有一批PbO和PbO2的混合物样品,用高锰酸钾法测定其含量。称取该样品加入20.00ml 0.2500mol·L-1草酸溶液,将PbO2还原为Pb2+,然后用氨水中和溶液,使全部Pb2+形成PbC2O4沉淀,化学方程式为:
PbO2 + 4H+ + C2O42-== Pb2+ +2H2O + CO2↑
Pb2+ + H2C2O4 + 2NH3·H2O == PbC2O4↓+ 2NH4+ + 2H2O
过滤后将滤液酸化,用标准KMnO4溶液滴定,共用0.04mol·L-1KMnO4溶液10.00ml;沉淀溶解于酸中再用同浓度的KMnO4标准溶液滴定,用去了30.00ml,化学方程式为:
2MnO4- + 5C2O42-+ 16H+ == 2Mn2+ + 10CO2↑+ 8H2O
计算试样中PbO和PbO2的质量分数(摩尔质量:PbO2-239g/mol,PbO-223g/mol)
35.a mol 铁和bmol硫磺在隔绝空气条件下加热,使两者充分反应,然后
将反应混合物与足量的稀硫酸溶液在适当的条件下反应,通过计算回答:
(1)生成的气体在标准状况下的体积(L)为多少?
(2)生成的气体在标准状况下的密度ρ(g/L)的取值范围(用分式表示)是多少?
(3)若生成的气体不少于b mol时,则a、b的关系是什么?
(4)当a+b=1时,欲使产生的气体的密度为最大值,则a、b的取值范围各为多少?
36.(1)将标准状况下11.2L的NH3气体溶于100mL水中,得到密度为0.868g·cm-3的氨水。求所得氨水的物质的量浓度是多少?
(2)将上述氨水30mL与70mL2mol· L-1的AlCl3溶液相混合,生成a克沉淀,则a的数值为多少?
(3)往上述(2)反应后未过滤的浊液中加入VmL5mol· L-1 的NaOH溶液后。沉淀物的质量仍为a克,则V的取值为多少?
37.已知反应BeCl2+Na2BeO2+2H2O==2NaCl+2Be(OH)2能完全进行,则下列推断中,正确的是
A. BeCl2溶液的pH<7,将其蒸干并灼烧后,得到残留物可能为BeO
B. Na2BeO2溶液的pH>7,将其蒸干并灼烧后,得到残留物可能为BeO
C. Be(OH)2只能溶于盐酸不能溶于烧碱溶液
D. BeCl2水溶液的导电性强,因此BeCl2一定是离子化合物
参考答案
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| B | C | D | D | B | B | D | C | A | D | A | C | D | B | C |
| 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
| C | B | D | D | A | B | B | B | C | C |
二、(本题包括3小题)
26.(1)①Al2(SO4)3和过量的KOH ②AgNO3、NH4Cl和过量的KOH
(2)继续滴加稀硝酸至溶液明显呈酸性,若白色沉淀溶解,是Al2(SO4)3和过量的KOH的混合物,若白色沉淀不溶解,是AgNO3、NH4Cl和过量的KOH的混合物。
27.(1)不漏气。 由于不漏气,加水后试管内气体体积减小,导致压强增大,长颈漏斗内的水面高出试管内的水面。
(2)无法确定。 由于分液漏斗和烧瓶间有橡皮管相连,使分液漏斗中液面上方和烧瓶中液面上方的压强相同,无论装置是否漏气,都不影响分液漏斗中的液体滴入烧瓶。
(3) ①Na2SO4、Na2CO3、Na2SiO3、Na2SO3
②取少量该溶液加入试管中,向其中加入稀盐酸。如果出现白色沉淀,则原溶液是Na2SiO3溶液;若产生无色、无味的气体,则原溶液是Na2CO3溶液;若产生无色、有刺激性气味的气体,则原溶液是Na2SO3溶液;若无明显现象出现,则说明为Na2SO4溶液。(本题为开放题,若有其它推测,且检验方案正确,均给分)
28.(1) C (2)保证CuSO4·nH2O中的结晶水完全失去
(3)160(m2-m3)/18(m3-m1)
(4)①加热时FeCl3生成Fe2O3 ②加热时FeSO4生成Fe2(SO4)3
三、(本题包括2小题)
29.(1)H ,Na (2)2 ,ⅥA (3)E>B>C>D>A
(4)NH4HCO3
![]() NH3↑+ H2O + CO2↑ (5)乙二酸(草酸)
NH3↑+ H2O + CO2↑ (5)乙二酸(草酸)
30.(1)FeC2O4
·2H2O![]() FeC2O4+2H2O↑ 通过计算可知:加热减少的质量刚好等于
FeC2O4+2H2O↑ 通过计算可知:加热减少的质量刚好等于
1.000gFeC2O4·2H2O所含结晶水的质量,即可确认反应中失去的是H2O。
(2)FeO、CO、CO2,1:1:1 (3)30%
(4)6Fe2O3
![]() 4Fe3O4+O2
↑
4Fe3O4+O2
↑
四、(本题包括2小题)
![]() 31. ⑴HO-CH2CHO ⑵ CO(NH2)2 ⑶ C8H8O -OH
31. ⑴HO-CH2CHO ⑵ CO(NH2)2 ⑶ C8H8O -OH
32. (1) B:BrCH2—CH=CH—CH2Br F:![]()
![]() (2)①③
(2)①③
![]() (3)②CH2Br—CH=CH—CH2Br +2H2O HOCH2—CH=CH—CH2OH+2HBr
(3)②CH2Br—CH=CH—CH2Br +2H2O HOCH2—CH=CH—CH2OH+2HBr
![]()
⑤ + 3NaOH NaOOC—CH=CH—COONa
+ NaCl +3H2O
![]()
 ⑧
⑧
n
(4)不合理, 防止碳碳双键被氧化,保护碳碳双键。
(5)不合理, 防止H分子间发生羧基间脱水生成酸酐,保护羧基。
五、(本题包括3小题)
33.(1)NH4+; Al3+; SO42-
(2)NH4+ + OH-△NH3↑+ H2O n(NH4+) == 0.224 L/22.4L·mol-1 == 0.01 mol
Ba2+ + SO42-== BaSO4↓ n(SO42-)== 4.66g/233g·mol-1 == 0.02mol
2Al3+ ~ Al2O3
2mol 102g
n(Al3+) 0.51g n(Al3+)=0.01mol
0.01mol×18g·mol-1 + 0.01mol×27g·mol-1 + 0.02 mol×96g·mol-1 == 2.37g
m(H2O) == 0.5×9.06g −2.37g ==2.16g n(H2O) ==2.16g/18g·mol-1 == 0.12mol
故n(NH4+):n(Al3+):n(SO42-) :n(H2O) == 0.01mol:0.01mol:0.02mol:0.12mol == 1:1:2:12
所以结晶水合物的化学式为:NH4Al(SO4)2·12H2O
34.PbO%== 65.1% PbO2%== 34.9%
35.(1)22.4a (2)1/11.2<ρ<17/11.2
(3)a≥b (4)1/2≤b<1;0<a≤1/2
36.4 mol· L-1, 3.12克 V==104mL
37.A
| 停课后几天化学复习建议 1. 时间:每天必须保证有1—2小时的时间复习化学 2.整理:化学方程式、10张选择题、最近考过的理综卷——圈出问题 3.练习:本张化学卷,4份理综卷,考纲中的题型示例——平均完成 4.看书:浏览课本,着重书中的如无机有机材料、实验——防止死角 |