高考章节复习(氧族元素精选选择题)
1.除去二氧化碳中混有的少量二氧化硫气体,可选用的试剂是
A. 饱和碳酸钠溶液 B. 高锰酸钾溶液
C. 石灰水 D. 饱和碳酸氢钠溶液
2.元素X的气态氢化物的分子式为H2X,这种元素的最高价氧化物的水化物的化学式可能是
A. H2XO3 B. X(OH)2 C. H2XO4 D. H6XO6
3.含有元素硒(Se)的保健品现在已开始进入市场,下列关于硒的叙述错误的是
A. 最高价氧化物的化学式为SeO3 B. 原子序数为24
C. 气态氢化物的化学式为H2Se D. 非金属性比溴弱
4.不能说明氧的非金属性比硫强的是
A. 在通常状况下,氧的单质为气体,硫的单质为固体
B. 氢硫酸溶液在空气中置露会变浑浊
C. 硫化氢在加热的条件下既可分解成氢气和硫,而水在强高温时很少分解
D. 铜与硫反应生成硫化亚铜,与氧气反应生成氧化铜
5.在氯化钡溶液中通入SO2,溶液仍澄清,若将氯化钡溶液分装两只试管,一支加硝酸,另一支加NaOH溶液,然后再通入SO2,结果两试管中都有白色沉淀生成。由此得出下列结论合理的是
A. 氯化钡有两性
B. 两支试管中的白色沉淀都是BaSO4
C. SO2具有还原性和酸性
D. 升高pH值使SO2水溶液中SO32-浓度增大
6.下列反应中亚硫酸表现的性质,其中一种与另外三种不同的是
A. 能使酸性高锰酸钾褪色 B. 在空气中易被氧化变质
C. 能使溴水褪色 D. 在溶液中加入氢氧化钡溶液产生白色沉淀
7.某元素的硫酸盐的分子量为a,同价态的该元素的碳酸盐的分子量为b,则该元素的化合价数值为
A. (a-b)/(a+b) B. (b-a)/36 C. (a-b)/36 D. (b-a)/18
8.等物质的量的SO2和Cl2混合后,缓慢通入Ba(NO3)2溶液,再滴入品红试液,应发生的现象是
A. 无沉淀生成,溶液显红色 B. 无沉淀生成,溶液显无色
C. 有沉淀生成,溶液显无色 D. 有沉淀生成,溶液显红色
9.一种盐A和酸B反应,可放出有气味的气体C,C与NaOH溶液反应生成A,C最终氧化成D,D溶于水可生成B,则A和B分别是
A. Na2SO3和HNO3 B. Na2SO3和H2SO4 C. Na2S和H2SO4 D. Na2S和HNO3
10.下列关于浓硫酸的叙述正确的是
A. 浓硫酸具有吸水性,因而能使蔗糖炭化
B. 浓硫酸在常温下可迅速与铜片反应放出二氧化硫气体
C. 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D. 浓硫酸在常温下能够使铁、铝等金属钝化
11.下列离子方程式正确的是
A. 硫氢化钠溶液跟稀硝酸相混合:HS-+H+=H2S↑
B. 向硫酸氢钠溶液中滴入氢氧化钡溶液至pH=7:
Ba2++OH-+H++SO42-=BaSO4↓+H2O
C. 铜跟稀硝酸反应:3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O
3Cu2++2NO↑+4H2O
D. Cl2通入FeBr2中使其中1/2Br-被氧化:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
12.CS2是一种有恶臭气味的液体,将其滴入用硫酸酸化的KMnO4溶液中时生成单质硫并放出CO2,当生成 0.5 mol CO2时转移电子的物质的量是
A.1 mol B.4 mol C.3 mol D.2 mol
13.某溶液含有较多的 Na2SO4 和少量的 Fe2(SO4)3 ,若用该溶液制取芒硝,可供选择的操作有:①加适量 H2SO4 溶液②加金属 Na ③结晶④加过量 NaOH ⑤加强热脱结晶水⑥过滤。正确的操作步聚是
A.②⑥③ B.④⑥①③ C.④⑥③② D.②⑥①③⑤
14.唐代医书《外台秘要》一书中记载了水银霜的制法:将水银(即汞)和硫磺共炒后再加入NaCl灼炒之,倒扣一铜盆,片刻后,铜盆内壁便附着一层白色的水银霜。据此可知水银霜的化学成分为
A.HgS B.Na2S C.HgCl2 D.Hg2Cl2
15.提纯含有少量硝酸钡杂质的硝酸钾溶液,可以使用的方法为
A.加入过量碳酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
B.加入过量硫酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
C.加入过量硫酸钠溶液,过滤,除去沉淀,溶液中补加适量硝酸
D.加入过量碳酸钾溶液,过滤,除去沉淀,溶液中补加适量硝酸
16.能正确表示下列反应的离子方程式是( )
A.硫化亚铁跟盐酸反应:FeS+2H+===Fe2++H2S↑
B.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+===Fe3++4H2O
C.用氨水吸收过量二氧化硫:NH3·H2O+SO2===NH4++HSO3—
D.硫酸铜溶液跟氢氧化钡溶液反应:Ba2++SO42—===BaSO4↓
17.在加热情况下能和浓H2SO4反应放出刺激性气味气体,并将气体通入水中呈酸性,通入溴水或酸性KMnO4溶液中,颜色都消失的物质是
A.氧化亚铁 B.二氧化锰 C.氧化铜 D.木炭粉
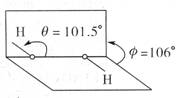 18.我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供衍射实验的单晶体,经测定H2O2结构如右图所示,结合以上信息,有关过氧化氢的说法不正确的是
18.我国前科学院院长卢嘉锡与法裔加拿大科学家Gignere巧妙地利用尿素(H2NCONH2)和H2O2形成加合物H2NCONH2·H2O2,不但使H2O2稳定下来,而且结构也没有发生改变,得到了可供衍射实验的单晶体,经测定H2O2结构如右图所示,结合以上信息,有关过氧化氢的说法不正确的是
A.H2NCONH2与H2O2是通过氢键结合的
B.H2O2是极性分子
C.H2O2既有氧化性又有还原性
D.H2NCONH2·H2O2属离子化合物
19.将H2S和O2的混合气体在120 ℃的温度下,装入密闭容器中,高温下使之燃烧,已知反应物全部参加了反应,反应后容器恢复到120 ℃时,测得压强为反应前的3/4,则原混合气体中H2S与O2的物质的量之比为
A.1∶1 B.1∶2 C.2∶3 D.2∶1
20.下列溶液中: ①石灰水 ②H2S溶液 ③KMnO4溶液 ④溴水 ⑤酸化的Ba(NO3)2溶液 ⑥品红溶液,不能区别SO2和CO2气体的是
 A.只有① B.①③ C. ①②③⑤ D.②③④⑤
A.只有① B.①③ C. ①②③⑤ D.②③④⑤
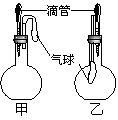
21.如图所示的甲、乙两个装置中,胶头滴管中吸入某种液体,平底烧瓶中充入(或放入)另一种物质,挤压胶头滴管加入液体,一段时间后两装置中的气球都有明显地胀大(忽略液体体积对气球的影响)。则所用试剂分别可能依次是
A、甲:浓硫酸和木炭 乙:浓氨水和SO2
B、甲:双氧水和MnO2 乙:NaOH溶液和CO2
C、甲:苯酚和Na2CO3溶液 乙:NaOH溶液和Cl2
D、甲:浓硫酸和蔗糖(滴有几滴水) 乙:水和氨气
22.常温下,向20L真空容器中通入amol硫化氢,与bmol氯气(a,b均为正整数,且均≤5),反应后可生成硫固体和另一种气体,则容器内可能达到的最大密度是
A. 35.5g/L B. 17.85g/L C. 18.25g/L D. 19.45g/L
23.吸进人体内的O2,有2%转化为氧化性极强的活性氧副产物,如![]() 等,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用含硒化合物Na2SeO3清除人体内的活性氧。在消除活性氧时,Na2SeO3的作用是
等,这些活性氧能加速人体衰老,被称为“生命杀手”。中国科学家尝试用含硒化合物Na2SeO3清除人体内的活性氧。在消除活性氧时,Na2SeO3的作用是
A.还原剂 B.氧化剂 C.既是氧化剂,又是还原剂 D.以上均不是
24.下列变化中可以说明SO2具有漂白性的是
A.SO2通入酸性高锰酸钾溶液中红色褪去 B.SO2通入品红溶液红色褪去
C.SO2通入溴水溶液中红棕色褪去 D.SO2通入氢氧化钠与酚酞的混合溶液红色褪去
25.从矿物学资料查得,一定条件下自然界存在如下反应: 14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4 下列说法正确的是
A.CuSO4是氧化剂,FeS2既是氧化剂又是还原剂
B.当生成7molCu2S时,共转移电子14mol
C.产物中的SO42-离子全部是氧化产物
D.该反应中氧化剂、还原剂的物质的量之比为14︰5
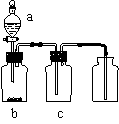 26.用右图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
26.用右图装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是
| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | NaOH溶液 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
| D | CO2 | 稀硫酸 | CaCO3粉末 | 浓硫酸 |
27. 将n mol K2SO3和m mol Na2S溶于水,用稀硫酸酸化后,若生成物分别是: ①SO2和S ,②H2S和S,③只有S,则n与m之比值从 (Ⅰ)1∶2,(Ⅱ)大于1∶2;(Ⅲ)小于1∶ 2 中选出符合上述情况的组合是
A.(Ⅰ)(Ⅱ)(Ⅲ) B.(Ⅱ)(Ⅲ)(Ⅰ) C.(Ⅲ)(Ⅱ)(Ⅰ) D.(Ⅱ)(Ⅰ)(Ⅲ)
28.目前排放到空气中的二氧化碳逐年增加,对此科学家最担心的是
A.会使空气中的氧含量下降,不足以供给人类呼吸
B.会使地球温度升高,冰川融化,生态失衡
C.会使人体吸进大量二氧化碳,损害健康
D.会使石灰岩大量溶解,破坏自然风光
29.储存浓H2SO4的铁罐外口出现严重的腐蚀现象。这体现了浓硫酸的
A.吸水性和酸性 B.脱水性和吸水性
C.强氧化性和吸水性 D.不挥发性和酸性
30.有下列结论:①微粒半径:S2—>C1>S>F;②氢化物的稳定性:HF>HCl>H2S>H2Te;③离子的还原性:S2—>C1—>Br—>I—;④氧化性:Cl2>S>Se>Te;⑤酸性:H2SO4>HClO4>H2SeO4;⑥非金属性:F>C1>S>Se。其中正确的是
A.②④⑥ B.①③④ C.只有① D.只有⑥
31.KCl溶液中混有K2S、KI,为了除去杂质并将它们逐一分离,选用如下操作:①通入C12;②加碘水;③用CCl4萃取;④过滤;⑤分液。正确顺序是
A.①②③④⑤ B.②④①③⑤ C.⑤②①④③ D.④⑤③②①
32.有一瓶无色气体,可能含有H2S、CO2、HBr、HCl、SO2中的一种或几种。向其中加入氯水,得到无色透明溶液。把溶液分成两份:向一份中加入氯化钡一盐酸混合溶液,出现白色沉淀;向另一份中加入硝酸银一硝酸混合溶液,也有白色沉淀。结论:①原气体中肯定有SO2;②原气体中肯定没有H2S、HBr;③原气体中肯定有HCl;④不能肯定原气体中是否有HCl;⑤原气体中肯定没有CO2。以上结论中正确的是
A.①②③⑤ B.①②③ C.①②④ D.①②
33.在复印室工作时会闻到一股特殊的气味,离复印机越近,该气味越浓.若用润湿的KI淀粉试纸接近该气体,则试纸会变蓝,则该物质的化学式是
A、Cl2 B、NO2 C、O3 D、N2
34.一定量的锌与100 mL 18.5 mol·L-1的浓H2SO4充分反应后,锌完全溶解,同时生成标准状况下的气体33.6 L。将反应后的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol·L-1。则生成的气体中SO2和H2的体积比为
A、1:2 B、2:1 C、1:4 D、4:1
35.0.1 mol某单质与足量的硫在一定条件下充分反应后,质量增加了1.6 g,则该单质可能是
A.钠 B.铜 C.铁 D.铝
36.为方便某些化学计算,有人将98%的浓硫酸表示成下列形式,其中合理的是
A.H2SO4·1/9 H2O B.H2SO4·H2O
C.H2SO4·SO3 D.SO3·10/9H2O
37.能鉴别CO2和SO2的试剂是
A.酚酞溶液 B.澄清石灰水 C.紫色石蕊试液 D.氯化钡溶液和氯水混合液
38.为了除去混在CO2气体中的SO2和O2气,以下试剂:①饱和Na2CO3溶液;②饱和NaHCO3溶液;③浓H2SO4;④灼热铜网;⑤碱石灰,使用顺序正确的是
A.①③④ B.②③④ C. ③④⑤ D.③②⑤
39.在热的稀硫酸中投入铜片,然后通入空气,实验现象是( )
A.无明显现象,因不发生反应 B.铜片溶液,有二氧化硫生成
C.铜片溶解,溶液变蓝
D.铜片变黑,有氢气生成
40.下列各组物质关系中,与O2和O3关系相同的一组是
A、Na和Na+ B、S4和S8 C、![]() H和
H和![]() H D、水和重水
H D、水和重水
41.下列离子方程式正确的是
A、Ba(OH)2溶液中滴入足量的NaHCO3溶液:Ba2++OH-+HCO3-=BaCO3↓+H2O
B、Ba(OH)2溶液中滴入CuSO4溶液:2OH-+Cu2+=Cu(OH)2↓
C、盐酸和澄清的石灰水混合:H++OH-=H2O
D、Cu与浓硫酸反应:Cu2++4H++SO42-=Cu2++SO2↑+2H2O
42.在标准状况下,将amol H2S和bmol O2混合充分燃烧后,两反应物都没有剩余,得到三种产物(S、SO2和H2O),则下列判断不正确的是 ( )
A、产生的SO2是(b一1/2a)mol B、反应后生成的水质量为18ag
C、3a>2b>a D、反应后氧化产物的质量为(16a-32b)g
43.下列离子方程式中不正确的是
A.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+====Ca2++2H2O+2CO2↑
B.碘化钾溶液跟适量溴水反应:2I-+Br2====I2+2Br-
C.将金属钠加入水中:Na+2H2O====Na++2OH-+H2↑
D.将Cl2通入亚硫酸溶液中:Cl2+H2SO3+H2O====H++SO![]() +2Cl-
+2Cl-