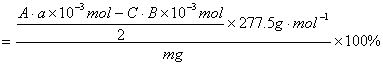高三二轮复习讲义
滴定的综合题
题目:1、某学生用邻苯二甲酸氢钾(相对分子质量为204)测定NaOH溶液的浓度,若NaOH溶液的浓度在0.1mol/L左右,滴定终点时溶液的PH约为9.1。
① 用结构简式表示邻苯二甲酸氢钾与NaOH反应的化学方程式 。
② 将用托盘天平称好的邻苯二甲酸氢钾放于锥形瓶中,加适量的水溶解,溶液无色,再加入指示剂 (从甲基橙、酚酞、石蕊中选择),用NaOH溶液滴定到终点时,现象是 。
③ 完成该实验主要要用到哪些玻璃仪器 (举二种)。
④ 该学生进行三次实验,所取固体的质量均相同,填写下表:
| 实验编号 | 邻苯二甲酸氢钾的质量(g) | 待测NaOH溶液的体积(mL) |
| 1 |
| 18.2 |
| 2 | 17.1 | |
| 3 | 16.9 |
⑤ 滴定中误差较大的是第 次实验,造成这种误差的可能原因是(只填写三种即可):
A、 ;B、 ;C、 。
⑥ NaOH溶液的物质的量浓度为 。
评题:此题是一道学科内知识的实验综合题,看似简单,实不一般。它有以下几个特点,⑴不同于传统实验如实验装置分析、实验方案设计与评价、框图分析等的考查方式,而是以类似于实验报告的形式给出,学生既熟悉(形式)又陌生(内容);⑵立足基础,对有机、实验、计算等主干知识进行了考查,可以较好的测试学生的理解能力、推理能力和分析综合能力;⑶设置开放性问题,能考查学生的发散性思维能力,体现能力立意的思想。
分析:① 邻苯二甲酸氢钾是教材中没有的,怎么写呢?这就需要进行知识迁移。联想到NaHCO3,它是碳酸的酸式盐,碳酸是二元酸,其结构为HO—C—OH,可知NaHCO3的
O O
结构为HO—C—ONa,由此,可将NaHCO3看作是碳酸中的一个—OH里的H原子被Na原子替换所得到的。邻苯二甲酸也是二元酸,这是大家熟悉或易推测的,类比,
![]() 邻苯二甲酸氢钾的结构简式为
那么,它与NaOH反应的化学方程式为
邻苯二甲酸氢钾的结构简式为
那么,它与NaOH反应的化学方程式为
![]()
![]() + NaOH =
+ H2O
+ NaOH =
+ H2O
② 知道邻苯二甲酸氢钾的结构情况以后,很容易判断其水溶液显酸性。那么,用NaOH滴定酸性溶液时,可选择酚酞为指示剂。
③ 主要是注意审题,只能答“玻璃仪器”,象铁架台、滤纸等就不能填。另外,还要有灵活性,象锥形瓶在题目中就出现了,可以算一种。
④ 解决此小题,必须注意以下二个问题:一是计算邻苯二甲酸氢钾的质量时,千万不能把0.1mol/L直接代入计算式,因为,题目说“NaOH溶液的浓度在0.1mol/L左右”,而且,第⑤问是求“NaOH溶液的物质的量浓度”,也就是说0.1mol/L是一个不准确、近似的数字。这就要求学生有一定的审题能力、理解能力,对试题要有个整体把握能力。二是对表格中数据的处理问题,比较表中提供的三次实验数据,发现第1次实验数据与2、3两次实验数据相差较大,说明该次实验误差较大,在数据处理过程中应弃用。故消耗待测NaOH溶液的体积的平均值为 (17.1mL+16.9mL)/2=17.0mL。明了上述问题,可设NaOH溶液的浓度为Cmol/L,所取邻苯二甲酸氢钾固体的质量为M g,根据题意,滴定到终点是,溶液呈碱性,因此有:(C×17.0×10–3-M/204)/17.0×10–3=10–4.9,变形,近似处理为C×17.0×10–3=M/204,即M=3.468C。考虑到这里,就又有一个障碍需要突破了,那就是C和M从何处入手讨论的问题。要注意到,邻苯二甲酸氢钾固体是用托盘天平称量的,因此,M的精度只能为小数点后面一位。如果C取0.1mol/L或其附近的值,M只能为0.4(g)。那么,当M=0.4g时,考虑有效数字知识,C的准确值为0.115mol/L。
答案:① 见上述分析内容 ② 酚酞 无色变成浅红色且在半分钟内不褪色 ③ 碱式滴定管 锥形瓶 ④ 0.4g ⑤ 1 滴定管只用水洗,未用NaOH润洗 滴定前滴定管尖嘴处有气泡,滴定后消失 滴定终点判断不准,溶液呈红色 ⑥ 0.115mol/L。
启示:① 综合性实验试题命题方式可以突破传统习惯,内容可以不是很深,但要求高,一是必须具备扎实的基本功,如较强的数据处理能力、熟悉各量器的精度等;二是必须具备较强的灵活性及推理分析能力,能充分运用所学的知识来解答问题,象本题中邻苯二甲酸氢钾的结构简式的推测、开放性问题的解答等。② 在实验复习备考过程中,不能“话实验”或“画实验”,要真正走进实验室去做实验、看仪器、想问题、组装置,既动手实践,又动笔完成实验报告,尤其是实验报告的完成还没有引起一些学生和老师的足够重视。分析了这一道习题后,启示我们要尽可能的将学生实验的每一个环节都落到实处,切实、全面、有效的提高学生的实验能力。
题目:2某光卤石(KCl·MgCl2·6H2O)样品中含有不跟NaOH溶液,盐酸反应的杂质.某校化学课外活动研究小组现欲测定此样品中含KCl·MgCl2·6H2O的质量分数,经讨论有多种实验测定方案.
请根据提供的实验试剂和仪器(所需的仪器任选),选择精确度较高的实验测定方案,简要写出第二步以后的实验步骤和实验结果.
一、可选用的实验试剂:
(1)a mol·L-1NaOH溶液 (2)b mol·L-1Na2CO3溶液 (3)c mol·L-1HCl溶液
(4)d mol·L-1AgNO3溶液 (5)酚酞试液 (6)甲基橙试液
二、实验步骤:
第一步:称取mg 样品,放入250ml烧杯中,加适量水溶解
第二步:……
计算样品中含KCl·MgCl2·6H2O(式量为277.5)的质量分数表达式:_________________
命题意图:本题原是已知具体实验步骤,要求学生按照实验所得数据求样品的质量分数,现在命题者将原实验题的实验步骤拆掉一部分,从而造成实验途径多样性,要求学生根据实验要求及具体细节来确定实验最佳途径。因此,本题以光卤石样品中KCl·MgCl2·6H2O的质量分数测定为题设情景,通过设置的多重性实验途径和具体细节,让学生完成光卤石样品的质量分数所需的实验步骤和质量分数表达式。考查学生思维广阔性、周密性、深刻性及批判性。
解题思路:
1、 由条件找关系
可能的离子反应:
①Mg2++2OH-=M(OH)2↓ ②Mg2++CO32-=MgCO3↓ ③Ag++Cl-=AgCl↓
分别与KCl·MgCl2·6H2O可能构成的关系式有:
2OH -→Mg2+→M(OH)2→KCl·MgCl2·6H2O
CO32-→Mg2+→MgCO3↓→KCl·MgCl2·6H2O
Ag+→Cl-→AgCl↓→1/3KCl·MgCl2·6H2O
由上述关系可见,求KCl·MgCl2·6H2O的量,可从所加试剂的量入手,也可用生成沉淀的质量的进行计算来求得。
2、由实验操作的难易确定最佳途径
①测定沉淀的质量:需要过滤、洗涤、烘干,步骤多误差较大
②测定所加试剂的量:可通过滴定法,精确度较高,操作较简便。
由此可见,方法②为最佳途径。
3、再由细节,求完善
⑴为了使沉淀完全,沉淀剂必须过量;过量的试剂必须准确测出,涉及的实验步骤要尽可能少。
⑵中和滴定中指示剂的选择也很关键。仅仅从中和反应本身来讲,甲基橙、酚酞皆可用,但在此实验中影响到实验操作的难易。如选甲基橙作滴定过量碱的指示剂,就必须对生成的Mg(OH)2沉淀进行过滤、洗涤且将洗涤液合并后,再进行滴定;如选酚酞试液作指示剂,Mg(OH)2沉淀就无需过滤,因为酚酞变色范围在pH=8~10,滴定到终点时Mg(OH)2沉淀不会溶解。显然,用酚酞作指示剂简化了实验步骤,提高了实验的精确度,所以应选用酚酞作为测定过量的NaOH 的指示剂。
综合1、2、3的分析具体解答如下:
(第一步题中已定)
第二步:加入A mL a mol·L-1NaOH溶液(过量),充分反应;
第三步:直接在反应后的溶液中滴加酚酞指示剂2~3滴
第四步:用c mol·L-1HCl溶液滴定至由浅红色为无色止。消耗HCl 溶液B mL
KCl·MgCl2·6H2O%