《几种常见的金属》历年高考题
15、将等物质的量的镁和铝相混合,取等质量该混合物四份,分别加到足量的下列溶液中,充分反应后,放出氢气最多的是( )
(A) 3摩/升HCl (B) 4摩/升HNO3
(C) 8摩/升NaOH (D) 18摩升H2SO4
21.0.1摩镁粉分别在足量的O2、CO2、N2中燃烧,生成固体的质量依次为W1、W2、W3.下列关系式正确的是( ).
(A) W2>W1>W3 (B) W1=W2>W3
(C) W1=W2=W3 (D) W3>W2>W1
26、在由Fe、FeO和Fe2O3组成的混合物中加入100毫升2摩/升的盐酸,恰好使混合物完全溶解,并放出448毫升气体(标准状况),此时溶液中无Fe3+离子。则下列判断正确的是
A 混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3
B 反应后所得溶液中的Fe2+离子与Cl- 离子的物质的量之比为1:2
C 混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D 混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多
14、将铁屑溶于过量盐酸后,再加入下列物质,会有三价铁生成的是
A、硫酸 B、氯水 C、硝酸锌 D、氯化铜
20、由锌、铁、铝、镁四种金属中的两种组成的混和物10克,与足量的盐酸反应产生的氢气在标准状况下为11.2升,则混和物中一定含有的金属是
A、锌 B、铁 C、铝 D、镁
25、第二主族元素R的单质及其相应氧化物的混合物12g,加足量水经完全反应后蒸干,得固体16g,试推测该元素可能为
A Mg B Ca C Sr D Ba
18、甲、乙两烧杯中各成盛有100mL 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为
A 5.4g B 3.6g C 2.7g D 1.6g
2.用铜锌合金制成的假金元宝欺骗行人的事件屡有发生。下列不易区别其真伪的方法是
(A)测定密度 (B)放入硝酸中 (C)放入盐酸中 (D)观察外观
22.制印刷电路时常用氯化铁溶液作为“腐蚀液”:发生的反应为2FeCl3+Cu=2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是
A. 烧杯中有铜无铁 B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有 D.烧杯中铁、铜都无)14.氯化铁溶液与氢氧化铁胶体具有的共同性质是
A 分散质颗粒直径都在l~100nm之间 B 能透过半透膜
C 加热蒸干、灼烧后都有氧化铁生成 D 呈红褐色
7.下列说法正确的是
A.硬水是指含有很多盐的海水
B.重水是指密度大的液态H2O
C.溴水是指溴的水溶液
D.王水是指3体积浓硝酸和1体积浓盐酸的混合液
8.把生铁冶炼成碳素钢要解决的主要问题是
A.除去生铁中的各种杂质,把生铁提纯
B.适当降低生铁里的含碳量,除去大部分硫、磷等有害杂质
C.用还原剂把铁的氧化物还原成铁
D.加入合金元素改善生铁性能
16.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,这说明维生素C具有
A 酸性 B 碱性 C 氧化性 D 还原性
12、在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示氢氧化加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是
Y Y Y Y
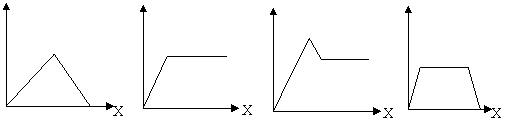 |
A B C D
9.家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A 4Fe(OH)2+2H2O+O2=4Fe(OH)3↓ B 2Fe+2H2O+O2=2Fe(OH)2↓
C 2H2O+O2+4e=4OH- D Fe-3e=Fe3+
8.铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的HCl和NaOH物质的量之比为
A.1:1 B.2:1 C.3:1 D.1:3
16.将表面已完全钝化的铝条,插入下列溶液中,不会发生反应的是
A.稀硝酸 B.稀盐酸 C.硝酸铜 D.氢氧化钠
36.六价铬对人体有毒,含铬废水要经化学处理后才能排放,方法是用绿矾(FeSO4·7H2O)把废水中的六价铬还原为三价铬离子,再加入过量的石灰水,使铬离子转变为氢氧化铬Cr(OH)3沉淀.其主要反应的化学方程式如下:H2Cr2O7+6FeSO4+6H2SO4=3Fe2(SO4)3+Cr2(SO4)3+7H2O
现用上法处理1×104升含铬(+6价)78毫克/升的废水(Cr相对原子质量52),试回答:
(1)处理后,沉淀物中除Cr(OH)3外,还有 、 (用化学式表示).
(2)需用绿矾多少千克?
37.现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1摩,在此溶液中加入90毫升4摩/升的NaOH溶液,使其充分反应.设Al3+物质的量与总物质的量的比值为x.
(1)根据反应的化学方程式计算x=0.4时,溶液中产生的沉淀是什么?物质的量有多少?
(2)计算沉淀中只有Fe(OH)3的x取值范围.
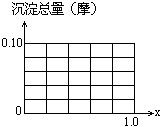
请在下图中画出沉淀总量(摩)随x(0→1)变化的曲线.
(3)若Al3+和Fe3+物质的量之和为A摩(A为合理数值),其他条件不变时,求沉淀中同时有Fe(OH) 3、Al(OH) 3的x取值范围和各沉淀的物质的量(用含有A、x的式子表示
27、铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。配平制取铁酸钠的化学方程式:Fe(NO3)+NaOH+Cl2─Na2FeO4+NaNO3+NaCl+H2O
反应中 元素被氧化,转移电子总数为
铁酸钠之所以能净水,除了能消毒外,另一个原因是
24、在热的稀硫酸溶液中溶解了11.4g FeSO4。当加入50mL 0.5mol/L KNO3溶液后,使其中Fe2+的全部转化成Fe3+,KNO3也反应完全,并有NXOY氮氧化物气体逸出。FeSO4 + KNO3 + H2SO4 →K2SO4 +Fe2(SO4)3+ NXOY+H2O
(1)推算出X= Y=
(2)配平该化学方程式(系数填写在上式方框内)
(3)反应中氧化剂为
(4)用短线和箭头标出电子转移的方向和总数
32.(6分)取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470g冷却后加入足量水,将反应产物加热蒸干并灼烧,得到的氧化镁质量为0.486 g。
(1)写出氮化镁与水反应生成氢氧化镁和氨的化学方程式。
(2)计算燃烧所得混合物中氮化镁的质量分数。
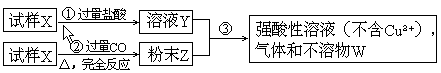 30.(5分)试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按下图所示进行实验:
30.(5分)试样X由氧化亚铁和氧化铜组成.取质量相等的两份试样按下图所示进行实验:
(1)请写出步骤③中所发生的全部反应的离子方程式.
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为_____________.(用m表示)
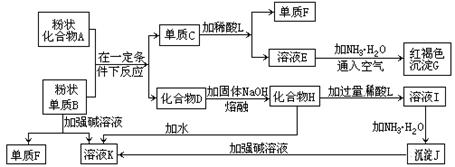 28.(8分〕提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
28.(8分〕提示:某些金属氧化物跟熔融烧碱反应可生成盐。根据以下化学反应框图填空:
(1)单质F是_____________________。
(2)写出由E生成G的离子反应方程式(或化学方程式)________________。
(3)溶液I中所含金属离子是_____________________。
(4)由C→E+F若改用浓酸,则不能选用的浓酸是(写分子式)__________。
29.我国规定饮用水质量标准必须符合下列要求:
| PH值 | 6.5-8.5 |
| Ca2+,Mg2+总浓度 | <0.0045mol/L |
| 细菌总数 | <100个/mL |
以下是源水处理成自来水的工艺流程示意图
|
|
|
|
|
→ →
源水中含Ca2+、Mg2+、![]() 、CL-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_____________
、CL-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式_____________
凝聚剂除去悬浮固体颗粒的过程__________(填写编号,多选倒扣)
①只有物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O常用的凝聚剂,它在水中最终生成___________沉淀。
通入二氧化碳的目的是_________________和_____________。
气体A的作用是__________。这种作用是基于气体A和水反应的产物具有______________性。
下列物质中,______________可以作为气体A的代用品。(填写编号,多选倒扣)
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
31.已知Fe2O3在高炉中有下列反应:Fe2O3+CO→2FeO+CO2
反应形成的固体混和物(Fe2O3、FeO)中,元素铁和氧的质量比用 mFe︰mO表示。
(1)上述固体混和物中,mFe︰mO不可能是 (选填 a、b、c多选扣分)
(a)21︰9 (b)21︰7.5 (c) 21︰6
(2)若mFe︰mO=21︰8,计算Fe2O3被CO还原的百分率
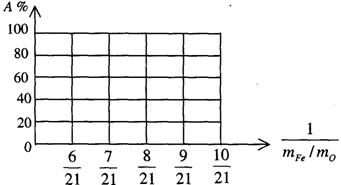 (3)设 Fe2O3被CO还原的百分率为A%,则A%和混和物中mFe︰mO的关系式为(用含mFe、mO的代数式表示)。
(3)设 Fe2O3被CO还原的百分率为A%,则A%和混和物中mFe︰mO的关系式为(用含mFe、mO的代数式表示)。
A%=
请在下图中画出A%和mFe/mO关系的图形。
(4)如果 Fe2O3和CO的反应分两步进行:
3Fe2O3+CO→2Fe3O4+CO2
Fe3O4+CO→3FeO+CO2
试分析反应形成的固体混和物可能的组成及相应的mFe︰mO(令mFe︰mO=21︰a,写出a的取值范围)。将结果填入下表。
| 混和物组成(用化学式表示) | a的取植范围 |
22.(10分)已知X为FeO和CuO的混合物,取两份等质量的X样品进行下列实验:
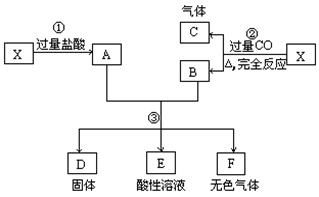 (1)写出①、②和③步所有反应的化学方程式;
(1)写出①、②和③步所有反应的化学方程式;
(2)设从③步所得固体D的质量为32 g,溶液E中只含有一种金属离子,气体F在标准状况下体积为5.6 L,试计算取用的每份X的质量和X中FeO与CuO的质量比。
31.硫铁矿高温下空气氧化产生二氧化硫:4FeS2+11O2→8SO2+2Fe2O3
设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00mol FeS2完全氧化,需要空气的体积(标准状况)为 L
(2)55L空气和足量FeS2完全反应后,气体体积(同温同压)变为 L
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100L,其中O2为aL,SO2为bL。
① 写出a和b的关系式
② 在右图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)
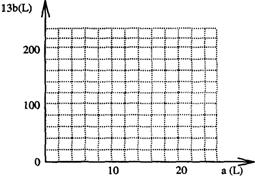 说明:为方便作图,纵坐标用13b表示
说明:为方便作图,纵坐标用13b表示
 33.(22分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
33.(22分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入 。
(2)除去蒸馏水中溶解的O2常采用 的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是 。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
30.超细氮化铝粉末被广泛应用于大规模集成电路生产等领域。其制取原理为:Al2O3+N2+3C![]() 2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
2AlN+3CO由于反应不完全,氮化铝产品中往往含有炭和氧化铝杂质。为测定该产品中有关成分的含量,进行了以下两个实验:
(1)称取10.00g样品,将其加入过量的NaOH浓溶液中共热并蒸干,AlN跟NaOH溶液反应生成NaAlO2,并放出氨气3.36L(标准状况)。
①上述反应的化学方程式为 ;
②该样品中的A1N的质量分数为 。
(2)另取10.00g样品置于反应器中,通入2.016L(标准状况)O2,在高温下充分反应后测得气体的密度为1.34g·L-1(已折算成标准状况,AIN不跟O2反应)。该样品中含杂质炭 g。
26.(12分)
孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2(x、y为正整数且![]() )
)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。
孔雀石: ;石青: 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO23.36L(标准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定
该混合物中孔雀石和石青的物质的量之比。
(04上海)31.黄铜矿(主要成分CuFeS2)是提取铜的主要原料
(1)取12.5g黄铜矿样品,经测定含3.60g硫(杂质不含硫),矿样中CuFeS2含量为
|
(2)已知 2CuFeS2 + 4O2 ───→ Cu2S + 3SO2 + 2FeO (炉渣)
产物Cu2S在1200℃高温下班继续反应:
2Cu2S + 3 O2 → 2Cu2O + 2 SO2
2 Cu2O + Cu2S → 6Cu + SO2
假定各步反应都完全,完成下列计算:
①由6 mol CuFeS2生成6 mol Cu,求消耗O2的物质的量
②6 mol CuFeS2和14.25 mol O2反应,理论上可得到多少摩尔铜
③6 mol CuFeS2和15.75 mol O2反应,理论上可得到多少摩尔铜