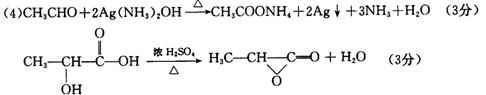
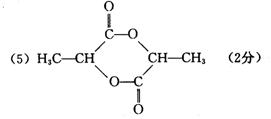
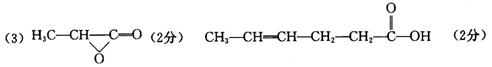高中三年级第三次统一考试理科综合试题(化学部分)
第一卷(选择题)
6.常温下,已知1L溶液中已电离的水的物质的量是10-11mol ,在此溶液中肯定能大量共存的离子组是
A.K+、Na+、NO3-、Cl- B. CO32-、Cl-、Na+、K+
C.Mg2+、NO3-、K+、Cl- D. NO3-、NH4+、SO42-、K+
7.在恒温恒容的密闭容器中发生可逆反应2A(g)+B(g) ![]() 2C(g),此容器起始时分别加入下列各组物质,达到平衡时逆反应速率最大的是
2C(g),此容器起始时分别加入下列各组物质,达到平衡时逆反应速率最大的是
A.2molA和1molB B.1molA和1molB C.2molC D.1molA和2molC
8.最新研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS)。已知羰基硫分子中所有原子最外层均满足8电子结构,结合元素周期表知识,下列有关说法正确的是
A.羰基硫属于非极性分子 B.羰基硫的电子式为
C.羰基硫属于原子晶体 D.羰基硫分子中三个原子处于同一直线上
9.设NA为阿伏伽德罗常数,下列说法正确的是
A.78g Na2O2固体中含有的离子数目为4NA
B.500mL0.5mol·L-1的Ca(ClO)2溶液中,含有的ClO-数目为0.5NA
C.25℃时1mL水中所含H+数目为1×10-10NA
D.在标准状况下,1L乙醇完全燃烧产生CO分子的数目为NA/11.2
10.在给定条件下的化学反应中,下划线的物质被完全消耗的
A.用浓盐酸与过量的二氧化锰共热制取氯气
B.在常温下, 将1g 铝片投入到20mL 18.4 mol·L-1的硫酸中
C.向100mL3 mol·L-1的硝酸溶液中加入5.6g 铁粉
D.在50Mpa、500℃和铁触媒催化的条件下,用氮气和过量的氢气合成氨
11.短周期元素X和Y可形成X2YO3型离子化合物,下列说法中正确的是
A.X、Y不可能是同一周期的元素 B.X2YO3的水溶液一定呈碱性
C.X2YO3与盐酸反应不可能产生沉淀 D.Y元素的单质形成的晶体一定为原子晶体
12.1,5-戊二醛(简称GA)是一种重要的饱和直链二元醛。2%的GA溶液具有广谱、高效、无刺激、无腐蚀的特点,对禽流感、口蹄疫、猪瘟等有良好的防治作用。根据以上信息,判断下列说法中不正确的是
A. GA的分子式为C5H8O2,符合此分子式的二元醛共有3种
B.1molGA与足量新制Cu(OH)2悬浊液在加热条件下反应生成2molCu2O
C.1molGA在一定条件下与足量H2充分反应,能消耗2molH2
D.2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用
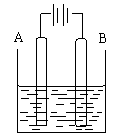 13.按右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解液
13.按右图的装置进行电解实验:A极是铜锌合金,B极为纯铜,电解液
中含有足量的铜离子。通电一段时间后,A极恰好全部溶解,此时B极的
质量增加7.68g ,溶液的质量增加0.03g,则A合金铜锌的物质的量之比为
A.4︰1 B.3︰1 C.2︰1 D.任意比
第二卷
26.(13分)下图是元素周期表的一部分,表中所列字母分别代表某一化学元素:
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | ||||||||||||||
| i | |||||||||||||||||
(1)i是铁,其原子的最外层电子数为2,画出铁元素的原子结构示意图 。
(2)以上元素形成的金属单质中,熔点最低的是 (填元素符号),a和c两种元素组成的化合物分子属于 (填“极性”或“非极性”)分子
(3)已知CH3COONH4溶液为中性,试判断(NH4)2CO3溶液的pH 7(填“大于”、“小于”或“等于”)。将同温度下等物质的量浓度的四种盐溶液①NH4HCO3;②CH3COONH4;③(NH4)2SO4;④NH4Cl,按pH由大到小的排列顺序是: (填序号)。
(4)现有Fe、Al合金9.8g ,将其溶解在稍过量的稀硝酸中,假设硝酸的还原产物全部为NO,且在标准状况下的体积为4.48L,则向反应后的溶液中加入足量的氨水可生成的氢氧化物沉淀的质量是 g。
27.(16分)某化学活动小组想通过下图所示装置(加持装置已略去)进行实验,探究NO和Na2O2反应的产物。实验前,他们查阅得到如下信息:2NaNO3![]() 2NaNO2+O2↑,NaNO2为白色晶体,既有氧化性又有还原性;NO有毒,易溶于乙醇,其结构有类似于碳碳双键的不饱和键。实验开始时,先在A中加入了足量的稀硝酸,通入足量N2后,在将铜丝插入稀硝酸中,回答下列问题:
2NaNO2+O2↑,NaNO2为白色晶体,既有氧化性又有还原性;NO有毒,易溶于乙醇,其结构有类似于碳碳双键的不饱和键。实验开始时,先在A中加入了足量的稀硝酸,通入足量N2后,在将铜丝插入稀硝酸中,回答下列问题:
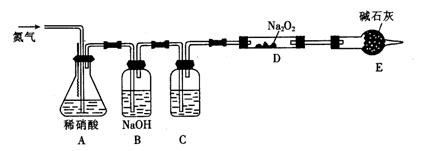
(1)写出Cu和稀硝酸反应的离子方程式 。
(2)通入N2的目的是 。
(3)装置C中的试剂是 ,E的作用是 。
(4)假如Na2O2已反应完全,为确定D中固体产物的成分,甲同学取适量固体溶于水,将溶液加热一段时间后冷却,测其pH,发现溶液显强碱性,再取此溶液逐滴滴加到酸性KMnO4溶液中,紫色褪去,由此现象你推断固体产物中可能含有的物质是 (填化学式)。
(5)乙同学取适量固体于试管中密闭加热,发现白色固体部分变为淡黄色,由此现象说明固体产物中还可能含有的物质是 (填化学式)。
(6)该实验装置的主要缺点是尾气吸收装置,改进的措施是将尾气: (填序号)
①通入NaOH溶液中 ②通入溴水中 ③通入乙醇中 ④用球胆或塑料袋收集
28.(13分)下列框图中,A是人类不可缺少的调味品,B为淡黄色的物质,J为空气中的主要成分之一,G为正盐。
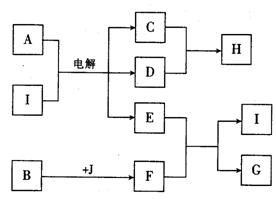
根据上述信息回答下列问题:
(1)工业上制取H的反应条件是 。
(2)若E和F恰好安全反应,则反应的A与B的物质的量之比为 。
(3)写出D与G溶液反应的离子方程式 。
(4)若在BaCl2溶液中先通入适量F,再分别通入足量NH或NO,溶液中均有白色沉淀生成,则该白色沉淀分别为 、 。
(5)已知中和热为57.3kJ·mol-1,写出E的稀溶液和稀硫酸反应的热化学方程式:
。
29.(18分)已知某有机物A只含碳、氢、氧三种元素,分子中碳、氢、氧原子个数比为683。1molA与1molNaOH恰好完全中和,1molA只能与1molBr2发生加成反应,经测定A的相对分子质量不大于250,E在常温下为液体,各有机物的转化关系如下框图所示。
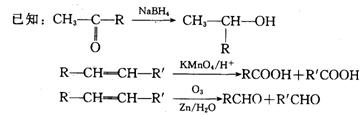
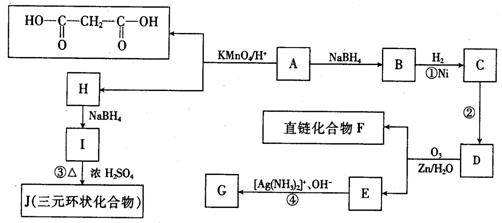
(1)写出A的分子式 ,化合物F含有的官能团名称是 。
(2)反应的条件是 。
(3)J的结构简式是 ,D的结构简式是 。
(4)写出下列反应的化学方程式:
E![]() G:
G:
I![]() J:
J:
(5)I分子间还能发生反应生成另 一种六元环状化合物,其结构简式为 。
参考答案:
6.A 7.D 8.D 9.C 10.C 11.B 12.A 13.B
 26.(13分)
26.(13分)
(1) (2分)
(2)Na(2分);极性(2分)
(3)大于(2分);①②④③(2分)
(4)20(3分)
27.(16分)
(1)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
(2)用N2排出整个装置中的空气(2分)
(3)浓硫酸(2分);防止空气中水蒸气和CO2进入D中干扰产物的判断(2分)
(4)Na2O、NaNO2(4分)
(5)NaNO3(2分)
(6)③④(错选和漏选得零分)
28.(13分)
(1)点燃(2分)
(2)2︰1(2分)
(3)SO32-+Cl2+H2O=SO42-+2Cl-+2H+(2分)
(4)BaSO3、BaSO4(4分)
(5)NaOH(aq)+![]() H2SO4(aq)=
H2SO4(aq)=![]() Na2SO4(aq)+H2O(l);△H=-57.3 kJ·mol-1
Na2SO4(aq)+H2O(l);△H=-57.3 kJ·mol-1
29.(18分)
(1)C6H8O3(2分);醛基、羧基(2分)
(2)浓硫酸 加热(2分)