解决化学平衡问题的重要思维方法
![]() 讨论: 1.在一个一定容积的密闭容器中,发生如下反应:A(气)+B(气) 2C(气),△H<0;下列说法正确的是( )
讨论: 1.在一个一定容积的密闭容器中,发生如下反应:A(气)+B(气) 2C(气),△H<0;下列说法正确的是( )
A.当反应达到平衡后,若升高温度,容器内压强不变 B.降低温度,气体的颜色变浅,则A、B中至少有一种有色气体 C.在一定温度下,当容器内气体压强不变时,说明反应已达平衡 D.若向容器内注入少量C,压强增大但平衡不移动,A的转化率也不变。
小结:
思维方法之一:单一和综合。即要考虑条件对平衡的综合影响,改变条件对平衡是单一的(理想的)还是综合的(实际的)
1、可逆反应:
![]() 2HI(g) H2(g)+I2(g)达到平衡状态,下列哪些操作不能使平衡发生移动(
)
2HI(g) H2(g)+I2(g)达到平衡状态,下列哪些操作不能使平衡发生移动(
)
(A)压强不变,充入少量H2
(B)容器体积不变,充入少量N2
(C)改变容器体积
(D)向平衡体系中充入少量NH3(g)
2、 A、B、C、D四种物质皆易溶于水。在稀溶液中建立了下列化学平衡:
![]() A+2B+H2O
C+D
A+2B+H2O
C+D
加水稀释时平衡向 反应方向移动,其理由是:
讨论
2.在一个一定容积的密闭容器中在某温度下发生如下反应:
![]() CO(g)+H2O(g) CO2(g)+H2(g)
CO(g)+H2O(g) CO2(g)+H2(g)
开始时充入容器中的起始物质是
①0.1molCO,0.1molH2O ;②0.1molCO,0.2molH2O;③0.1molCO,0.1molH2O,0.1molCO2;④0.1molCO,0.5molH2O,0.1molH2; ⑤ 0.1molCO,0.1molHCO,0.1molH2 ,0.1molCO2
达到平衡时容器中H2的浓度小到大排列是: 。
结论:
思维方法之二:“先同后变”或称过渡态。进行判断时可设相同的参照标准,再根据题设条件观察变化趋势。
练习
![]() 3.有两只密闭容器A和B,A容器有一个移动的活塞,使容器内保持恒压,B容器保持恒容。起始时这两只容器分别充入等量的体积比为2:1的SO2和O2混合气体,并使A和B容积相等,在保持400oC的条件下使之发生如下反应:2SO2+O2 2SO3;填写下列空白:
3.有两只密闭容器A和B,A容器有一个移动的活塞,使容器内保持恒压,B容器保持恒容。起始时这两只容器分别充入等量的体积比为2:1的SO2和O2混合气体,并使A和B容积相等,在保持400oC的条件下使之发生如下反应:2SO2+O2 2SO3;填写下列空白:
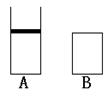 (1)达到平衡时所需时间,A容器比B容器 ,A容器中SO2转化率比B容器 。
(1)达到平衡时所需时间,A容器比B容器 ,A容器中SO2转化率比B容器 。
(2)达到(1)所述平衡后,若向容器中通人数量不多的氩气,A容器化学平衡向 移动。B容器化学平衡: 。
(3)达到(1)所述平衡后,若向容器中充入等量的原反应气体,A中SO3百分含量 (增大、不变、减小),B中SO3百分含量 (增大、不变、减小)。
讨论:
3、在一个密闭容器中充入2molSO2、1molO2和2molSO3,在一定条件下发生反应:
![]() 2SO2+O2 2SO3,则最终生成SO3的物质的量的范围是
。
2SO2+O2 2SO3,则最终生成SO3的物质的量的范围是
。
小结:
思维方法之三:大于零原则(可逆反应中的任何物质的物质的量总大于零)
练习
![]() 4.容积反应容器中,要求通过调节体系温度使A(g)+2B(g) 2C(g)达到平衡时保持气体总物质的量为12mol。现向反应容器中通人6.5molA、xmolB和2molC。欲使起始反应向逆反应方向移动,x的取值范围为:
。
4.容积反应容器中,要求通过调节体系温度使A(g)+2B(g) 2C(g)达到平衡时保持气体总物质的量为12mol。现向反应容器中通人6.5molA、xmolB和2molC。欲使起始反应向逆反应方向移动,x的取值范围为:
。
![]() 5. 在一定条件下,可逆反应A2(g)+B2(g) 2C(g)达到平衡时,各物质的浓度为:c(A2)=0.5mol/L, c(B2)=0.1mol/L, c(C)=1.6mol/L,若用a、b、c(均大于零)分别表示A2、B2、C的初始浓度,则:
5. 在一定条件下,可逆反应A2(g)+B2(g) 2C(g)达到平衡时,各物质的浓度为:c(A2)=0.5mol/L, c(B2)=0.1mol/L, c(C)=1.6mol/L,若用a、b、c(均大于零)分别表示A2、B2、C的初始浓度,则:
(1)a、b、c应满足的关系式是: 。
(2)a的取值范围是 。
讨论:
4.一定温度下,两个在容积均为1L的密闭容器A和B中,分别充入1molHI和2molHI,达到平衡时,HI的转化率分别为x%和y%,试比较x和y的大小
小结:
思维方法之四:扩大缩小
练习:
![]() 6.一定温度下,在容积不变的密闭容器中,存在着N2O4 2NO2 的平衡体系中,充入NO2或N2O4,则N2O4的转化率如何变化。
6.一定温度下,在容积不变的密闭容器中,存在着N2O4 2NO2 的平衡体系中,充入NO2或N2O4,则N2O4的转化率如何变化。
7. A和B两个容积完全相同的容器中,A中充有各1g的二氧化硫和氧气,B中充有各2g的二氧化硫和氧气。在同温下,反应达到平衡,设此时A中二氧化硫的转化率为a%,B中二氧化硫的转化率为b%,则其大小关系是( )
A.a%>b% B. a%≥b% C. a%<b% D. a%≤b%
反馈练习
1.在某条件下,容器中有如下平衡反应: 。
![]() A+4B 2C+D,△H<0;此时,A 、B、C的物质的量均为amol,而D的物质的量为dmol。
A+4B 2C+D,△H<0;此时,A 、B、C的物质的量均为amol,而D的物质的量为dmol。
(1)改变a的取值,再通过改变反应条件,可以使反应重新达到平衡。并限定达到新的平衡时,D的物质的量只允许在d/2到2d之间变化,则a的取值范围应是 (用a和d的关系式表示)。
(2)如果要使反应重新建立的平衡中,D的物质的量只允许在d到2d之间取值,则应该采取的措施是 (从下面列出的选项中选择)
(A)升高反应温度 (B)增大反应容器之压强 (C)增大反应容器之容积(D)降低反应温度 (E)减小反应容器之压 (F)减小反应容器之容积
2、A、B,C三个S02和02的气体反应体系,其中所含S02和02的物质的量依次为:2和l、2和3、4和6,分别在总体积不变和恒温的条件下进行S02的催化氧化,直至建立平衡。已知A的平衡体系的SO2转化率大于60%,试比较A、B、C三个平衡体系的:
(1)S02的转化率的大小; (2)02消耗率的大小。
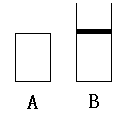 3、如图A、B两个容积相等的密闭容器,A能保持恒温恒容。B能保持恒温恒压,现将两个容器进行如下反应(A,B温度相等):
3、如图A、B两个容积相等的密闭容器,A能保持恒温恒容。B能保持恒温恒压,现将两个容器进行如下反应(A,B温度相等):
![]() 3A(g)+B(g) 2C(g)+D(g)
3A(g)+B(g) 2C(g)+D(g)
(1)取2molC和1molD放入A中与取6molA和2molB放入A中,达平衡时,C% 大(填前者、后者、一样,下同)
(2)取3molA、2molB放入A中与取2molC、1molD放入A中达到平衡时c(D) 大。
(3)取2molC、1molD及1mol稀有气体放入A中与取2molC、1molD放入B中,达到平衡时D的转化率 大。
(4)取1.5molA、0.5molB、1molC、0.5molD放入容器A与取3molA、1molB放入容器B达到平衡时,D% 大。