卤素高考化学试题选编
一.选择题
1.下列对溴化钠的描述中,正确的是
A.是一种可溶于水的晶体 B.跟硝酸银溶液反应可生成白色沉淀
C.跟浓硫酸反应是制取溴化氢气体的常用方法
D.其工业制法之一是将金属钠跟单质溴反应
2.漂粉精的有效成分是
A.Ca(OH)2 B.Ca(ClO)2 C.CaCl2 D.CaCO3
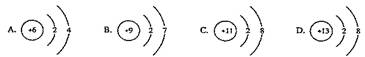
3在下图所表示的微粒中,氧化性最强的是
4.世界卫生组织(WHO)将二氧化氯ClO2列为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有着广泛应用。下列说法正确的是
A.二氧化氯是强氧化剂 B.二氧化氯是强还原剂
C.二氧化氯是离子化合物 D.二氧化氯分子中氯为负1价
5..“混盐”是指一种金属离子与多种酸根离子构成的盐,如氯化硝酸钙[Ca(NO3)Cl]就是一种混盐。“复盐”是指含有多种简单阳离子和一种酸根阴离子的盐如KAl(SO4)2,下列各化合物中属于混盐的是
A CaOCl2 B(NH4)2Fe(SO4)2 C BiONO3 D K3[Fe(CN)6]
6.近年来,我国某些地区出现了私自滥采黄金的现象,提炼过程一般要使用化学药品氰化物,其直接后果是
①污染水体 ②破坏臭氧层 ③危害工人的生命与健康 ④破坏植被
A.①② B.①②③ C.②④ D.①③④
7.等物质的量的KClO3分别发生下述反应:①有MnO2催化剂存在时,受热分解得到氧气;②若不使用催化剂,加热至470℃左右,得到KClO4(高氯酸钾)和KCl。
下列关于①和②的说法不正确的是
A.都是氧化还原反应 B.发生还原反应的元素相同
C.发生氧化反应的元素不同 D.生成KCl的物质的量相同
8..放在敞口容器中的下列溶液,久置后溶液中该溶质的浓度会变大的是
A.浓硫酸 B.氢氧化钠 C.氯水 D.氯化钠
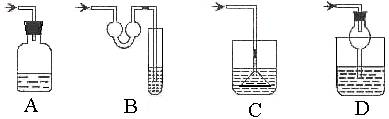
9. 19、以下各种尾气吸收装置中,适合于吸收易溶性气体,而且能防止倒吸的是
10.碘元素有多种价态,可以形成多种含氧阴离子IxOyn—。由2个IO62—正八面体共用一个面形成的IxOyn—的化学式为
A.I2O94— B.I2O106— C.I2O118— D.I2O1210—
二.非选择题
1通常用的漂白粉是次氯酸钙,氯化钙和氢氧化钙所组成的水合复盐,是由Cl2与消石灰制成的。漂白粉在潮湿的空气中放置会慢慢失效。有关反应如下:
2Cl2+3Ca(OH)2=Ca(ClO)2·CaCl2·Ca(OH)2·H2O+H2O
Ca(ClO)2+H2O +CO2=CaCO3↓+2HClO
(1)漂白粉的有效成分是 ;
(2)上述反应中,化合价有变化的元素是 ;
(3)漂白粉放置失效的原因是 。
2.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为650mg / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2 → KOCN+2KCl+H2O 被氧化的元素是 。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气。请配平下列化学方程式,并标出电子转移方向和数目: KOCN+ KOH+ Cl2 → CO2 + N2 + KCl + H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯 g。
三.推断题
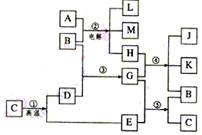 1.根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
1.根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
(1)单质L是 。
(2)化合物B是 。
(3)图中除反应①以外,还有两个用于工业生产的反应,是 和 (填代号)。
它们的化学反应方程式分别是 和 。
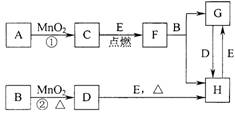 2..(9分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
2..(9分)下图所涉及的物质均为中学化学中的常见物质,其中C为O2、D为C12、E为Fe单质,其余为化合物。它们存在如下转化关系,反应中生成的水及次要产物均已略去。
(1)写出有关物质的名称或化学式:
B ,F ,H 。
(2)指出MnO2在相关反应中的作用:反应①中是 剂,反应②中是 剂。
(3)若反应①是在加热条件下进行,则A是 ;若反应①是在常温条件下进行,则A是 。
(4)写出B与MnO2共热获得D的化学方程式 。
3..A、B、C、D、E分别代表5种微粒,每种微粒中都含有18个电子。其中A和C都是由单原子形成的阴离子,B、D和E都是分子;又知在水溶液中A跟B反应可生成C和D;E具有强氧化性。请回答:
(1)用化学符号表示上述5种微粒:
A ,B ,C ,D ,E 。
(2)在水溶液中A跟B反应的离子方程式是: 。
4.已知:
①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。元素Y、X、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
(1)元素X是 ,Z是 。
(2)写出③中反应的化学方程式: 。
(3)写出④中反应的化学方程式: 。
5.(1)1986年,化学上第一次用非电解法制得氟气,试配平该反应的化学方程式:
K2MnF6+ SbF5 - KSbF6+ MnF3+ F2
反应中 元素被还原.
(2) 氰(CN)2、硫氰(SCN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素[如(SCN)2+ H2O==HSCN+HSCNO]它们阴离子的还原性强弱为:Cl-<Br-<CN-<SCN-<I-.试写出:
①(CN)2与KOH溶液反应的化学方程式
②NaBr和KSCN的混合溶液中加入(CN)2,反应的离子方程式
6..(14分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
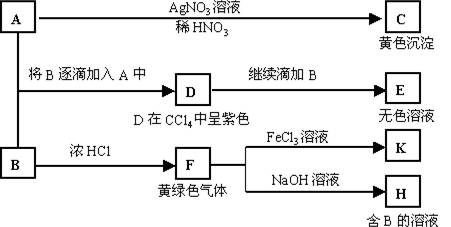
请回答:
(1)写出A、B和C的化学式:A ,B ,C 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式:
, 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式:
(4)写出由F→H的化学方程式: 。
四.实验题
129.(8分)某同学拟用氯化钙固体、碳酸钠溶液和稀硝酸等试剂,先制得碳酸钙,最终制得纯净的硝酸钙晶体。
(1)写出制取过程中反应的离子方程式:
、
(2)请帮助该同学完成下列实验操作步骤(不要求回答使用的仪器)
①用蒸馏水完全溶解CaCl2后,加入 。
②将反应后的混合物过滤,并用适量蒸馏水洗涤沉淀至无Cl-。
 ③加入
,使沉淀完全溶解。
③加入
,使沉淀完全溶解。
④ ,得到纯净的硝酸钙晶体。
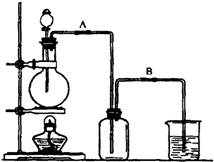
2.某校化学兴趣小组用浓盐酸与二氧化锰加热反应来制取并收集氯气,装置如下:
(1)写出该反应的化学方程式 。
(2)上述反应中,还原剂是 ,若有1mol氧化剂参加反应,转移的电子的物质的量是 mol。
(3)实验开始前,某学生对装置进行了气密性检查。方法是:连接好装置后,用弹簧夹夹住 处(填“A”或“B")橡皮管;向分液漏斗中加水并打开活塞,当加到一定量时,停止加水,静置观察,当观察到分液漏斗中 时,表明该装置不漏气。
(4)兴趣小组的某些同学准备在烧杯中加入下列溶液中的一种来吸收残余氯气,你认为其中错误的是(填序号) 。
A 氢氧化钠溶液 B 碳酸钠浓溶液 C 浓硫酸
3.在实验室里制取某些有毒气体时,为了尽量防止毒气逸散造成空气污染,有人设计了如下图所示的装置[Ⅰ]。并设想用[Ⅱ]或[Ⅲ]两种简易装置代替[Ⅰ]的b~c部分,以求达到同样的目的。
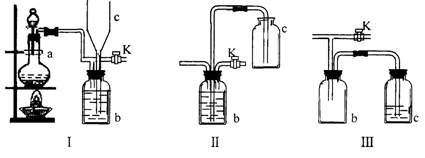
试回答:
(1)若用[Ⅰ]取氯气,b瓶加入的液体一般为 ______________。在选取试剂正确且适量的前题下,反应开始后,当关闭活塞K时如若发现c中液面不明显上升,你分析可能的原因是___________________检查的简单方法是_____________
(2)装置[Ⅰ]中b能防止多余气体逸散的原因是: _________________
4..(10分)
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
⑴ 第1步:灼烧。操作是将足量海带灼烧成灰烬,该过程中将使用到的硅酸盐质实验仪器有 _________________(填代号,限填3项)
A. 试管 B.瓷坩埚 C.坩埚钳 D.铁三角架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
⑵ 第2步:I— 溶液的获取。操作是_________________________________。
⑶ 第3步:氧化。 操作是依次加入合适的试剂,下列氧化剂最好选用_________(填代号),
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是________________________________________________。
⑷ 碘单质的检验。 操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
5..(14分)
在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
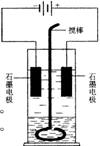 (1)阳极上的电极反应式为________________。
(1)阳极上的电极反应式为________________。
(2)阴极上的电极反应式为__________________。
(3)原上层液体是_______________________。
(4)原下层液体是______________________。
(5)搅拌后两层液体颜色发生变化的原因是______________________。
(6)要检验上层液体中含有的金属离子,其方法是_____________________,现象是________________________.
五.计算题
1.将![]() 氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼热后残留物的质量为
氯化钠、溴化钾和氯化钙的混合物溶于水中,通入氯气充分反应,然后把溶液蒸干并灼烧(高温加热),灼热后残留物的质量为![]() 。若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为
。若将此残留物再溶于水并加入足量的碳酸钠溶液,所得的沉淀经干燥后质量为![]() 。求原混合物中各化合物质量。
。求原混合物中各化合物质量。
2..(8分)较低温度下,氯气通入石灰乳中可制得漂白粉,该反应为放热反应。某校甲、乙两化学研究性学习小组均用200 mL 12 mol/L盐酸与17.4 g MnO2在加热条件下反应制备氯气,并将制备的氯气与过量的石灰乳反应制取漂白粉,用稀NaOH溶液吸收残余的氯气.分析实验结果发现:①甲、乙两组制得的漂白粉中Ca(ClO)2的质量明显小于理论值,②甲组在较高温度下将氯气与过量的石灰乳反应,所制得的产品中Ca(ClO3)2的含量较高。
试回答下列问题:
(1)上述实验中理论上最多可制得Ca(ClO)2多少克?
(2)实验中所得到的Ca(ClO)2的质量明显小于理论值,试简要分析其可能原因,并写出可能涉及到的化学方程式。
卤素高考题参考答案
一.1.A 2.B 3.B 4.A 5.A 6.D 7.D 8.D 9.B、D 10.A
二. 1(1)Ca(ClO)2(2)Cl (3)HClO不稳定发生分解
2. (1)碳(或C)(2)![]() (3)35.5
(3)35.5
三. 1. (1)H2 (2)H2O (3)②,④
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 2Ca(OH)2+2Cl2=Ca(OCl)2+CaCl2+2H2O
2NaOH+H2↑+Cl2↑ 2Ca(OH)2+2Cl2=Ca(OCl)2+CaCl2+2H2O
2. (1)HCl Fe3O4 FeCl3
(2)催化 氧化 (3)KClO3 H2O2
(4)MnO2+4HCl(浓)![]() MnCl2+C12↑+2H2O
MnCl2+C12↑+2H2O
3. (1)S2-, HCl, Cl-, H2S, F2 (2)S2-+2H+=H2S↑
4(1)Cl(或氯) K(或钾)
(2)Cl2+2KOH=KCl+KClO+H2O
(3)2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
5.(1)2 4 4 2 1 Mn(或锰)
(2)(CN)2+2KON=KCN+KCNO+ H2O 2SCN-+(CN)2=2CN-+(SCN)2
6.(1)NaI NaClO AgI
(2)2I-+ClO-+H2O=I2+Cl-+OH- I2+5ClO—+2OH—=2IO3-+5Cl-+H2O
(3)Fe3++SO32-+2H2O=Fe2-+SO42-+4H+
(4)Cl2+2NaOH=NaClO+NaCl+H2O
四.1(1)Ca2++CO32-=CaCO3↓ CaCO3+2H+==Ca2++CO2↑+H2O
(2)①碳酸钠溶液 ⑧稀硝酸 ④蒸发 结晶
2. (1)4HCl(浓)+MnO2![]() MnCl2+2H2O+Cl2↑ (2)HCl(盐酸或浓盐酸) 2
MnCl2+2H2O+Cl2↑ (2)HCl(盐酸或浓盐酸) 2
(3)B 液面(水面)不下降 (4)C
3. (1) 饱和食盐水;(2分)装置漏气;(1分)用湿润的碘化钾淀粉试纸先靠近各边接口处检验,漏气处试纸变蓝 (涂肥皂水等合理方法均可)
关闭活塞后,若a中仍有气体发生,气体压强增大。将b中液体压入c中,整个装置成为储气装置,不会有气体逸出。
4..(1)B E F
(2)将灰烬转移到烧杯中,加适量蒸馏水,用玻璃棒充分搅拌,煮沸,过滤
(3) D ,过氧化氢是绿色氧化剂,在氧化过程中不引进杂质、不产生污染(不会进一步氧化碘单质)
![]()
![]() 5.(1)2
5.(1)2![]() I2 (2)2
I2 (2)2![]() H2↑ (3)KI(或NaI等)水溶液 (4)CCl4(或CHCl3等)
H2↑ (3)KI(或NaI等)水溶液 (4)CCl4(或CHCl3等)
(5)I2在CCl4中的溶解度大于在水中溶解度,所以绝大部分I2都转移到CCl4中
(6)焰色反应 透过蓝色钴玻璃观察火焰呈紫色
五.计算题
1. NaBr 0.5g CaCl2 0.8g NaCl 8.7g
.设混合物中各物质的质量:NaCl为x,KBr为y,CaCl2为z。
x+y+z = 10.000 g……①
2KBr+Cl2 == 2KCl+Br2
混合物中KBr转化为KCl,灼烧后溴全部挥发,因此:
![]() ……②
……②
①式-②式得:
![]()
解得 y = 0.500 g
残留物溶于水后加入足量碳酸钠溶液,发生如下反应:
CaCl2+Na2CO3 = CaCO3↓+2NaCl
从所得CaCO3的质量可以算出CaCl2的质量:
![]()
氯化钠的质量为:
x = 10.000 g-0.500 g-0.800 g = 8.700 g
2.(05江苏25).(8分)
(1)根据题意
n(HCl) = 12 mol/L×0.2 L = 2.4 mol
n(MnO2) = 17.4 g÷87 g/mol = 0.2 mol
MnO2 + 4 HCl(浓) △ MnCl2 + Cl2↑+ 2H2O
n(MnO2)∶n(HCl) = 2.4 mol∶0.2 mol = 12∶1 > 4∶1
所以浓HCl过量,应根据MnO2计算。
根据制备氯气的化学方程式
n(Cl\2) = n(MnO2) = 0.2 mol
又因为:2Cl2 + 2Ca(OH)2 = Ca(ClO)2 + CaCl2 + 2H2O
n[Ca(ClO)2] = 1/2 n(Cl2) = 1/2×0.2 mol = 0.1 mol
m[Ca(ClO)2] = 143 g/mol × 0.1 mol = 14.3 g
(2)①随着反应进行,温度升高,会产生副产物Ca(ClO3)2;
6Cl2 + 6Ca(OH)2 △ 5CaCl2 + Ca(ClO3)2 + 6H2O
②Cl2未与石灰乳完全反应,残余Cl2被NaOH溶液吸收
Cl2 + 2NaOH = NaCl + NaClO + H2O