普通高等学校招生全国统一考试化学测试
第Ⅰ卷(共48分)
可能用到的相对原子质量:H 1 C 12 O 16
5. 下列说法正确的是
A.乙醇和汽油都是可再生能源,应大力推广“乙醇汽油”
B.钢铁在海水中比在河水中更易腐蚀,主要原因是海水含氧量高于河水
C.废弃的塑料、金属、纸制品及玻璃都是可回收再利用的资源
D.凡含有食品添加剂的食物对人体健康均有害,不宜食用
6. 下列说法正确的是
A.200 mL,1 mol/L Al2(SO4)3溶液中,Al3+ 和SO42—离子总数为6.02×1023
B.标准状况下,22.4 L Cl2和HCl的混合气体中含分子总数为2×6.02×1023
C.0.1 mol 8135Br原子中含中子数为3.5×6.02×1023
D.30 g甲醛中含共用电子对总数为4×6.02×1023
7. 下列叙述不正确的是
A.用酒精清洗沾到皮肤上的苯酚
B.用氨水清洗试管壁附着的银镜
C.用盐析的方法分离油脂皂化反应的产物
D.用冷凝的方法从氨气、氮气和氢气混合气中分离出氨
8. 已知:
①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;
②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;
 ③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。
下列判断正确的是
A.上述实验证明氧化性:MnO4—>Cl2>Fe3+>I2
B.上述实验中,共有两个氧化还原反应
C.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
D.实验②证明Fe2+既有氧化性又有还原性
9. 将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为b L(气体体积均在同温同压下测定)。该b L气体中NH3的体积分数是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
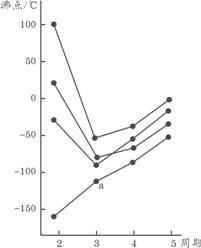
10.右图中每条折线表示周期表ⅣA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
A.H2S B.HCl C.PH3 D.SiH4
11.某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7。下表中判断合理的是
| 编号 | HX | YOH | 溶液的体积关系 |
| ① | 强酸 | 强碱 | V(HX)=V(YOH) |
| ② | 强酸 | 强碱 | V(HX)<V(YOH) |
| ③ | 强酸 | 弱碱 | V(HX)=V(YOH) |
| ④ | 弱酸 | 强碱 | V(HX)=V(YOH) |
A.①③ B.②③ C.①④ D.②④
12.R、W、X、Y、Z为原子序数依次递增的同一短周期元素,下列说法一定正确的是(m、n均为正整数)
A.若R(OH)m为强碱,则W(OH)n也为强碱
B.若HXOm为强酸,则Y是活泼非金属元素
C.若Y的最低化合价为-2,则Z的最高正化合价为+6
D.若X的最高正化合价为+5,则五种元素都是非金属元素
第Ⅱ卷(共60分)
25.(15分)
有机物A为茉莉香型香料。

Chenlong
(1)A分子中含氧官能团的名称_______________________。
(2)C的分子结构可表示为(其中R和R′代表不同的烃基)
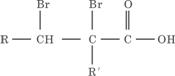
A的化学式是________________,A可以发生的反应是_____________(填写序号字母)。
a.还原反应 b.消去反应 c.酯化反应 d.水解反应
(3)已知含有烃基R的有机物R-OH与浓溴水反应产生白色沉淀,则含有烃基R′的有机
物R′—OH类别属于______________________。
(4)A分子结构中只有一个甲基,A的结构简式是___________________________________。
(5)在浓硫酸存在下,B与乙醇共热生成化合物C16H22O2的化学方程式是
__________________________________________________________________________。
(6)在A的多种同分异构体中,分子结构中除烃基R′含有三个甲基外,其余部分均与A相同的有______________种。
26.(17分)
X、Y、Z、W四种化合物均由短周期元素组成,其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。

请回答:
(1)W的电子式是 。
(2)X与Y在溶液中反应的离子方程式是 。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
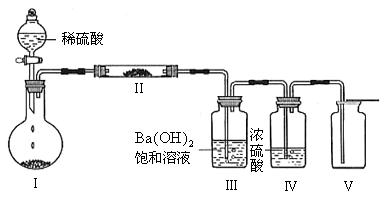
①装置Ⅰ中反应的化学方程式是 ,
装置Ⅱ中物质的化学式是 。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是 ,所需仪器装置是 (从上图中选择必要装置,填写编号)。
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是 。
27.(14分)
铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是__________________________________________________。
(2)铝与氢氧化钾溶液反应的离子方程式是________________________________________。
(3)工业品氢氧化钾的溶液中含有某些含氧酸杂质,可用离子交换膜法电解提纯。
电解槽内装有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。
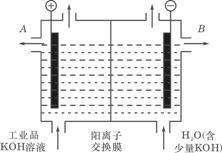
①该电解槽的阳极反应式是________________________________________________。
②通电开始后,阴极附近溶液pH会增大,请简述原因___________________________
_______________________________________________________________________________________________________________________________________________。
③除去杂质后的氢氧化钾溶液从溶液出口_________________(填写“A”或“B”)导出。
28.(14分)
有X、Y、Z三种元素,已知:
①X2-、Y-均与Y的气态氢化物分子具有相同的电子数;
②Z与Y可组成化合物ZY3,ZY3溶液遇苯酚呈紫色。
请回答:
(1)Y的最高价氧化物对应水化物的化学式是
(2)将ZY3溶液滴入沸水可得到红褐色液体,反应的离子方程式是:
,
此液体具有的性质是 (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b.插入电极通直流电后,有一极附近液体颜色加深
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)X单质在空气中燃烧生成一种无色有刺激性气味的气体。
①已知一定条件下,每1 mol该气体被O2氧化放热98.0 kJ。若2 mol该气体与1 mol O2在此条件下发生反应,达到平衡时放出的热量是176.4 kJ,则该气体的转化率为: 。
②原无色有刺激性气味的气体与含1.5 mol Y的一种含氧酸(该酸的某盐常用于实验室制取氧气)的溶液在一定条件下反应,可生成一种强酸和一种氧化物,若有1.5×6.02×1023个电子转移时,该反应的化学方程式是: 。
理综化学参考答案
5.C 6.D 7.B 8.A 9.C 10.D 11.D 12.B
25.(15分)Chenlong
(1)醛基
(2)C14H18O
a
(3)醇
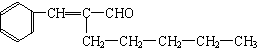
(4)
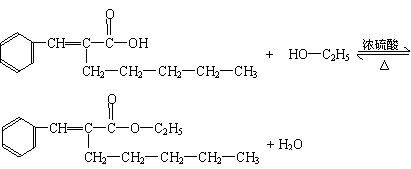
(5)
(6)3
26.(17分)
(1)![]()
(2)HCO3-+OH-=CO32-+H2O
(3)①Na2CO3+H2SO4= Na2SO4+ CO2↑+H2O
或2NaHCO3+H2SO4= Na2SO4+ 2CO2↑+2H2O
Na2O2
②H2O2
I、IV、V
(4)2Na2CO3+Cl2+H2O=NaClO + NaCl + 2NaHCO3
27.(14分)
(1)2Al2O3
![]() 4Al+3O2↑
4Al+3O2↑
(2)2Al+2OH—+2H2O=2AlO2—+3H2↑
(3)① 4OH——4e—=2H2O+O2↑
② H+ 放电,促进水的电离,OH— 浓度增大
③ B
28.(14分)
(1)HClO4
(2)Fe3++
3H2O ![]() Fe(OH)3
(胶体)+ 3H+
Fe(OH)3
(胶体)+ 3H+
a b d
(3)① 90%
② SO2+2HClO3=H2SO4+2ClO2