普通高等学校招生全国统一考试化学卷1
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷问(非选择题)两部分,第Ⅰ卷1至3页,第Ⅱ卷4至11页,共150分。考试用时120分钟。
第Ⅰ卷(选择题 共60分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考生号、座位号、考试科目、试卷类型(A)用铅笔涂写在答题卡上,同时将考生号条形码粘贴在答题卡“条形码粘贴处”。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号徐黑;如需改动,用橡皮擦干净后,再选涂其他答案;不能答在试题卷上。
3.考试结束,将本试卷和答题卡一并交回。
可能用到的原子量:H 1 C 12 N 14 O 16 Na 23 K 39
一.选择题(本题包括5小题,每小题4分,共20分。每小题只有一个选项符合题意。)
1.目前我国许多城市和地区定期公布空气质量报告,在空气质量报告中,一般不涉及
A SO2 B NO2 C CO2 D 可吸入颗粒物
2.为了除去蛋白质溶液中混入的少量氯化钠,可以采用的方法是
A 过滤 B 电泳 C 渗析 D 加入AgNO3溶液,过滤
3.铁屑溶于过量的稀硫酸,过滤后向滤液中加入适量硝酸,再加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为
A Fe(OH)3;Fe2O3 B Fe(OH)2;FeO
C Fe(OH)2、Fe(OH)3;Fe3O4 D Fe2O3;Fe(OH)3
4.六氯苯是被联合国有关公约禁止或限制使用的有毒物质之一。下式中能表示六氯苯的是
A 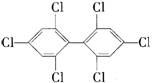 B
B 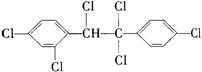
C 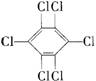 D
D 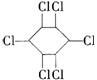
5.R、X、Y和Z是四种元素,其常见化合价均为+2价,且X2+与单质R不反应;X2++Z=X+Z2+;Y+Z2+=Y2++Z。这四种离子被还原成0价时表现的氧化性大小符合
A R2+>X2+>Z2+>Y2+ B X2+>R2+>Y2+>Z2+
C Y2+>Z2+>R2+>X2+ D Z2+>X2+>R2+>Y2+
二.选择题(本题包括10小题,每小题4分,共40分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项。只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该小题就为0分。)
6.室温时,0.01 mol·L-1某一元弱酸的电离度为1%,则下列说法正确的是
A 上述弱酸溶液的pH=4
B 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH=7
C 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH>7
D 加入等体积0.01 mol·L-1 NaOH溶液后,所得溶液的pH<7
7.周期表中16号元素和4号元素的原子相比较,前者的下列数据是后者的4倍的是
A 电子数 B 最外层电子数 C 电子层数 D 次外层电子数
8.将40 mL 1.5 mol·L-1的CuSO4溶液与30 mL 3 mol·L-1的NaOH溶液混合,生成浅蓝色沉淀,假如溶液中[Cu2+]或[OH-]都已变得很小,可忽略,则生成沉淀的组成可表示为
A Cu(OH)2 B CuSO4·Cu(OH)2
C CuSO4·2Cu(OH)2 D CuSO4·3Cu(OH)2
9.下列离子方程式书写正确的是
A 碳酸氢钙溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O
B 氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓
C 次氯酸钙溶液中通人过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
D 氯化亚铁溶液中加入硝酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
10.在原电池和电解池的电极上所发生的反应,同属氧化反应或同属还原反应的是
A 原电池的正极和电解池的阳极所发生的反应
B 原电池的正极和电解池的阴极所发生的反应
C 原电池的负极和电解池的阳极所发生的反应
D 原电池的负极和电解池的阴极所发生的反应
11.在一定温度下,向a L密闭容器中加入1mol X气体和2 mol Y气体,发生如下反应:X(g)+2Y(g)![]() 2Z(g)此反应达到平衡的标志是
2Z(g)此反应达到平衡的标志是
A 容器内压强不随时间变化
B 容器内各物质的浓度不随时间变化
C 容器内X、Y、Z的浓度之比为1︰2︰2
D 单位时间消耗0.1mol X同时生成0.2mol Z
12.在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得同温、同压下相同体积的氧气时,三个反应中转移的电子数之比为
A 1︰1︰1 B 2︰2︰1 C 2︰3︰1 D 4︰3︰2
13.1mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况下)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是
A 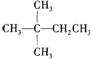 B CH3CH2CH2CH2CH3
B CH3CH2CH2CH2CH3
C 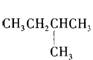 D CH3-
D CH3-![]() -CH3
-CH3
14.碘跟氧可以形成多种化合物,其中一种称为碘酸碘,在该化合物中,碘元素呈+3和+5两种价态,这种化合物的化学式是
A I2O3 B 12O4 C I4O7 D I4O9
15.1mol X气体跟a rnol Y气体在体积可变的密闭容器中发生如下反应:
X(g)+a Y(g)![]() b
Z(g)
b
Z(g)
反应达到平衡后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A a=1,b=1 B a=2,b=1 C a=2,b=2 D a=3,b=2
第Ⅱ卷(非选择题 共90分)
三.(本题包括2小题,共28分)
16.(I2分)已知化合物甲和乙都不溶于水,甲可溶于质量分数大于或等于98%的硫酸,而乙不溶。现有一份甲和乙的混合物样品,通过实验进行分离,可得到固体甲。(实验中使用的过滤器是用于过滤强酸性液体的耐酸过滤器。)
请填写表中空格,完成由上述混合物得到固体甲的实验设计。
| 序号 | 实验步骤 | 简述实验操作(不必叙述如何组装实验装置) |
| ① | 溶解 | 将混合物放入烧杯中,加入98% H2SO4,充分搅拌直到固体不再溶解。 |
| ② | ||
| ③ | ||
| ④ | ||
| ⑤ | 洗涤沉淀 | |
| ⑥ | 检验沉淀 |
17.(16分)根据下图回答问题:
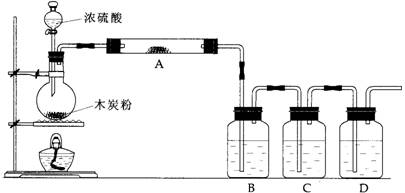
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气。
答:
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(3)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
A中加入的试剂是 ,作用是 。
B中加入的试剂是 ,作用是 。
C中加入的试剂是 ,作用是除尽 气体。
D中加入的试剂是 ,作用是 。
(4)实验时,C中应观察到的现象是 。
四.(本题包括3小题,共27分)
18.(9分)已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。
(1)请写出并配平上述反应的化学方程式。
(2)此反应的还原剂是 ,它的氧化产物是 。
(3)此反应的离子反应方程式可表示为:
。
(4)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
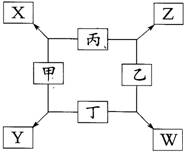 19.(10分)如图所示
19.(10分)如图所示
已知:
①甲、乙、丙、丁均为前三周期元素的单质。
②在一定条件下甲与丙和甲与丁都按物质的量之比1︰3反应,分别生成X和Y,在产物中元素甲呈负价。
③在一定条件下乙与丙和乙与丁都按物质的量之比1︰2反应,分别生成Z和W,在产物中元素乙呈负价。
请填空:
(1)甲是 ,乙是 。
(2)甲与丙反应生成X的化学方程式是
(3)乙与丁反应生成W的化学方程式是
20.(8分)将2mol H2O和2mol CO置于1L容器中,在一定条件下,加热至高温,发生如下可逆反应:
2H2O(g)![]() 2H2+O2
2H2+O2
2CO+O2![]() 2CO2
2CO2
(1)当上述系统达到平衡时,欲求其混合气体的平衡组成,则至少还需要知道两种气体的平衡浓度,但这两种气体不能同时是 和 ,或 和 。(填它们的分子式)
(2)若平衡时O2和CO2的物质的量分别为 n(O2)平=a mol, n(CO2)平=b mol。试求n(H2O)平= 。(用含a、b的代数式表示)
五.(本题包括2小题,共历分)
21.(6分)乙酸苯甲酯对花香和果香的香韵具有提升作用,故常用于化妆品工业和食品工业。乙酸苯甲酯可以用下面的设计方案合成。
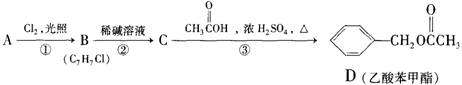
(1)写出A人的结构简式:
A ,C:
(2)D有很多同分异构体,含有酯基和~取代苯结构的同分异构体有五个,其中三个的结构简式是
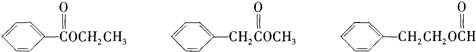
请写出另外两个同分异构体的结构简式:
和
22.(l0分)卤代烃在碱性醇溶液中能发生消去反应。例如
![]()
该反应式也可表示为
![]()
下面是八个有机化合物的转换关系
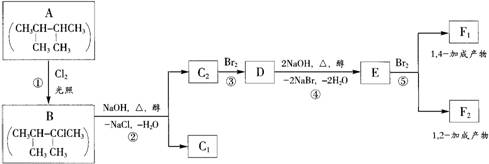
请回答下列问题:
(1)根据系统命名法,化合物A的名称是 。
(2)上述框图中,①是 反应,③是 反应。(填反应类别)
(3)化合物E是重要的工业原料,写出由D生成E的化学方程式
。
(4)C2的结构简式是 。F1的结构简式是 。
F1和F2互为 。
(5)上述八个化合物中,属于二烯烃的是 。二烯烃的通式是 。
六.(本题包括2小题,共19分)
23.(7分)在一定条件下,使H2和O2的混合气体26g充分发生反应。所得产物在适当温度下跟足量的固体Na2O2反应,使固体增重2g。求原混合气体中O2和H2的质量。
24.(12分)向300mL KOH溶液中缓慢通入一定量的CO2气体,充分反应后,在减压低温下蒸发溶液,得到白色固体。请回答下列问题:
(1)由于CO2通入量不同,所得到的白色固体的组成也不同,试推断有几种可能的组成,并分别列出。
(2)若通入CO2气体为2.24L(标准状况下),得到11.9g的白色团体。请通过计算确定此白色固体是由哪些物质组成的,其质量各为多少?所用的KOH溶液的物质的量浓度为多少?
化学高考参考答案
一、1 .C 2. C 3. A 4. C 5. A
二、6.AC 7.AD 8. D 9. CD 10. BC 11. AB 12.B 13. B 14. D 15. AD
三、16:②过滤 将烧杯中物质倒入耐酸过滤器中过滤,得滤液。
③析出沉淀 将滤液沿烧杯壁慢慢倒入足量水中,并不段搅拌,直至析出全部固体。
④过滤 将此烧杯中的物质倒入过滤器中过滤,得固体。
⑤ 用蒸馏水冲洗滤纸上的固体若干次,直至洗净。
⑥取新得到的洗出液少许,滴入用盐酸酸化的BaCl2 溶液 ,若没有白色浑浊出现,则说明沉淀已洗净,若有白色浑浊出现,则说明沉淀没有洗净。
17、(1)答:反应前点燃酒精灯,加热烧瓶一小会儿。在瓶B、C、D中出现气泡,熄灭酒精灯,瓶B、C、D中导管液面上升,证明该装置不漏气。
(2)2H2SO4(浓)+C![]() CO2↑+2SO2↑+2H2O
CO2↑+2SO2↑+2H2O
(3)无水硫酸铜 检验 H2O
品红溶液 检验 SO2
足量酸性 KMnO4 溶液 SO2
澄清石灰水 检验 CO2
(4) 导管有气泡冒出;溶液紫色逐渐变浅;瓶底有少量黑色固体生成。
18、(1)2MnSO4+5K2S2O8+8H2O![]() 2KMnO4+4K2SO4+8H2SO4
2KMnO4+4K2SO4+8H2SO4
(2)MnSO4 KMnO4
(3)2Mn2++5S2O82-+8H2O![]() 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
(4)盐酸、氯化钾
19、(1)氮 氧
(2)N2+3H2![]() 2NH3
2NH3
(3)O2+2Mg![]() 2MgO
2MgO
20、(1)H2O H2, CO CO2
(2)(2-2a-b) mol
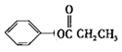
五、21:(1)A:![]() -CH3 C:
-CH3 C:![]() -CH2―OH
-CH2―OH
(2) 
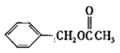
22、(1)2,3-二甲基丁烷
(2)取代 加成
(3)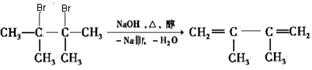
(4)![]() ,
,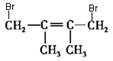 ,同分异构体
,同分异构体
(5) E , CnH2n-2 (n≥3)
六、23:Na2O2+H2![]() 2NaOH H2 被吸收完全,共2g。
2NaOH H2 被吸收完全,共2g。
2g
∴ O2 质量是 26g ―2g = 24g
24.(1)①K2CO3+KOH ②K2CO3 ③K2CO3+KHCO3 ④KHCO3
(2) 由:①CO2+2KOH=K2CO3+H2O ②CO2+KOH=KHCO3
22.4L(标态) 1.00mol即138g 22.4L(标态) 1.00mol即100g
2.24L(标态) 0.100mol即13.8g 2.24L(标态) 0.100mol即10.0g
∵ 13.8g>11.9g>10.0g
∴ 得到的白色固体是 K2CO3和KHCO3的混合物。
设白色固体中 K2CO3 x mol,KHCO3 y mol,即
①CO2+2KOH=K2CO3+H2O ②CO2+KOH=KHCO3
x mol 2x mol x mol y mol y mol y mol
![]() x mol+y mol=2.24L/22.4mol•L—1=0.100 mol (CO2)
x mol+y mol=2.24L/22.4mol•L—1=0.100 mol (CO2)
138g•mol—1 × x mol 100 g•mol—1 × y mol=11.9g (白色固体)
解此方程组,得
![]() x=0.0500mol (K2CO3)
x=0.0500mol (K2CO3)
y=0.0500mol (KHCO3)
∴ 白色固体中 ,K2CO3 质量为 138g•mol—1 × 0.0500mol=6.90g
KHCO3质量为 100 g•mol—1 ×0.0500mol=5.00g
消耗 KOH 物质的量为
2x mol+y mol=2×0.0500mol+0.0500mol=0.150mol
∴所用 KOH 溶液物质的量浓度为
0.150mol/0.300L = 0.500 mol•L—1
答:(略)。