高考模拟化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页,共150分。考试时间120分钟。
第Ⅰ卷(选择题 共72)
可能用到的相对原子质量:H 1 Li 7 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 K 39 Cs 133 Ba 137
一、选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.下列关于“生活中的化学”的叙述中不正确的是 ( )
A.棉花和蚕丝的主要成分都是纤维素
B.误食重金属盐,立即喝牛奶或生蛋清进行解毒
C.食用植物油的主要成分是高级不饱和脂肪酸甘油酯,是人体的营养物质
D.新居室内装饰材料中缓慢释放出的甲醛、甲苯等有机物会污染室内空气
2.目前,科学家拟合成一种“二重构造”的球形分子,即把足球型的C60分子熔进Si60的分子中,外面的硅原子与里面的碳原子以共价键结合。下列说法正确的是( )
A.它是由两种单质组成的混合物 B.它是一种硅酸盐
C.它是一种新型化合物 D.它是一种高聚物
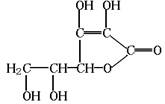 3.维生素C可用于预防和治疗坏血病等,其结构式如右下图所示。下列关于维生素C的叙述错误的是( )
3.维生素C可用于预防和治疗坏血病等,其结构式如右下图所示。下列关于维生素C的叙述错误的是( )
A.维生素C的化学式为C6H8O6
B.维生素C可作食品添加剂
C.维生素C可发生水解反应
D.维生素C不能发生氧化反应
4.发生原电池的反应通常是放热反应,在理论上可设计成原电池的化学反应是( )
A.C(s)+H2O(g)= CO(g)+H2(g);△H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(aq)+2NH3·H2O(l)+8H2O (l);△H>0
C.CaC2(s)+2H2O(l)→Ca(OH)2(s)+C2H2(g);△H<0
D.CH4(g)+2O2(g)→ CO2(g)+2 H2O (l);△H<0
5.下列操作正确的是 ( )
A.把pH试纸浸入溶液中测定溶液的pH
B.称量NaOH固体时,把NaOH固体放在有滤纸的托盘上称量
C.苯酚沾在皮肤上立即用酒精擦洗
D.用水清洗做过碘升华实验的试管
6.下列有关金属元素特征的叙述正确的是 ( )
A.金属元素的原子只有还原性而离子只有氧化性
B.金属元素的音质在常温下均为固体
C.金属元素在不同化合物中化合价均相同
D.金属元素在化合物中一定显正价
7.下列叙述正确的是( )
A.离子晶体中只存在离子键
B.原子晶体中只存在非极性共价键
C.冰是水分子间通过氢键作用有规则排列成的分子晶体
D.液态氯化钠和铜导线的导电原理是相同的
8.化合物甲是由氟元素和氧元素形成的一种不稳定的物质,10mL甲气体可分解成15mL
O2和10mLF2(气体都在同温同压下测定)。下列关于化合物甲的说法正确的是( )
![]() A.该化合物的分子式为O2F3
B.其电子式可表示为
A.该化合物的分子式为O2F3
B.其电子式可表示为
C.甲具有很强的氧化性 D.甲中氧元素的化合价为-2价
二、选择题(本题包括10小题,每小题4分,共40分,每小题只有一个或两个选择符合题意,若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个该小题就为0分。)
9.下列除去杂质的方法正确的是( )
A.除去甲烷中的乙烯:通过盛有溴的四氯化碳溶液的洗气瓶
B.除去甲苯中的苯酚:加入足量的溴水再过滤
C.除去乙醇中少量的水和氯化钠:加生石灰再加热蒸馏
D. 除去氨气中的水蒸气:通过装有五氧化二磷的U型管
10.下列各组离子在溶液中既可以大量共存,且加入氨水后不产生沉淀的是( )
A.K+ Ba2+ Cl- SO42- B.H+ NH4+ Al3+ SO42-
C.Na+ AlO2- NO3- OH- D. H+ Cl- CH3COO- NO3-
11.能正确表示下列化学反应的离子方程式是( )
A.氯化铝溶液中加足量碳酸氢钠溶液:Al3++3HCO3-=Al(OH)3↓+3CO2↑
B.氯气通入水中:Cl2+H2O=2H++ClO-+Cl-
C.过氧化钠和水反应:Na2O2+H2O=2Na++2OH-+O2↑
D.苯酚钠溶液中通入少量二氧化碳:CO2+H2O+2C6H5O-→2C6H5OH+CO32-
12.下列有关蛋白质的叙述正确的是( )
A.通过盐析作用析出的蛋白质再难溶于水
B.蛋白质溶液不能发生丁达尔现象
C.蛋白质溶液中的蛋白质能透过半透膜
D.天然蛋白质水解的最后产物都是α— 氨基酸
13.某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO3-的物质的量浓度之比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为( )
A.1:3 B.4:3 C.2:1 D.3:1
14.设NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.1mol金刚石晶体中含碳碳键数为2 NA
B.常温常压下,22.4L的D2、H2组成的气体分子数为NA
C.标准状况下,22.4LSO3中含有的氧原子数为0.3 NA
D.1molNa2O2与足量CO2反应转移的电子数NA
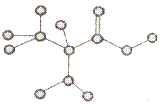 15.右图是某只含有C、H、O、N的有机物简易球棍模型。下列关于该有机物的说法正确的是( )
15.右图是某只含有C、H、O、N的有机物简易球棍模型。下列关于该有机物的说法正确的是( )
A.分子式为C3H7NO2
B.在一定条件下,可以通过聚合反应,生成高分子化合物
C.不能和盐酸溶液反应
D.不能和NaHCO3溶液反应,生成CO2
16.不用其他试剂无法鉴别的一组溶液是( )
A.硝酸银溶液和稀氨水 B.硫酸钠溶液和氯化钠溶液
C.碳酸钠溶液和稀盐酸 D.氯化铁溶液和氯化铜溶液
17.常温时0.1mol·L-1HA溶液的pH>1,0.1mol·L-1BOH溶液中c(OH-):c(H+)=1012,将两溶液等体积混合,以下判断正确的是( )
A. c(H+)< c(OH-)< c(A-)< c(B+)
B. c(OH-)< c(H+)< c(B+) < c(A-)
C. c(H+)+ c(B+)= c(A-)+ c(OH-)
D. c(A-)= c(B+)> c(H+)= c(OH-)
18.已知相同条件时碳酸中c(CO32-)比偏铝酸中c(AlO2-)大得多,则下列推论中正确的是( )
A.少量CO2通入NaAlO2溶液中,肯定有CO32-生成
B.含CO32-的溶液容易使Al(OH)3溶液变成AlO2-
C.HCO3-只能跟Al3+反应而不能和AlO2-反应
D.NH4+、AlO2-和HCO3-能大量共存于同一溶液中
第II卷(非选择题共78分)
三、(本题包括2小题,共20分)
19.(9分)在实验室利用胆矾晶体和烧碱溶液制备氧化铜固体,其实验操作可分解为如下几步:①混合 ②过滤 ③加热分解 ④溶解 ⑤洗涤。就此实验完成下列填空:
⑴正确操作步骤的顺序是(填序号) ;
⑵步骤②中所用到的玻璃仪器有 ;
⑶在实验中多次用到玻璃棒,其作用有三个,分别是 、 、 。
20.(11分)(1)实验室利用下图装置检验浓硫酸和木炭粉在加热条件下反应所得全部产物。
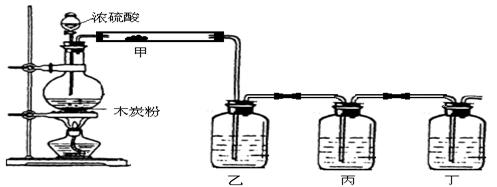
请回答:
①装置甲中应加的试剂是_________________;
②装置乙、丙和丁中所加试剂分别是___________(填下列选项的字母序号);
A.澄清石灰水、品红溶液、高锰酸钾酸性溶液
B.品红溶液、高锰酸钾酸性溶液、澄清石灰水
C.高锰酸钾酸性溶液、品红溶液、澄清石灰水
D.澄清石灰水、高锰酸钾酸性溶液、品红溶液
③实验时为了确保丁所验证的结论正确,丙中应观察到的现象是__________________。
(2)某校化学兴趣小组为测定混合物组成的质量比,实验过程中所加试剂和操作步骤如下表所示:
| 实验 序号 | 混合物A | 加入适量水得到 | 加入试剂B | 过滤后经洗涤干燥所得固体C | 蒸发滤液得到晶体D | 称量 |
| Ⅰ | BaCl2 NaCl | 溶液 | 过量CO2 |
| D | A、D |
| Ⅱ | CaCl2 NaCl | 溶液 | 过量饱和Na2CO3溶液 | CaCO3 | NaCl | A、C |
| Ⅲ | Na2SO4 MgSO4 | 溶液 |
试回答下列问题:
①实验Ⅰ中D的成分是_____________,通过称量后_______(填“能”或“不能”)计算得到A中各组分的质量比。
②实验Ⅱ填写的内容中一定错误的是___________,其原因是______________________。
③对实验Ⅲ进行设计,并将相应内容填入Ⅲ中对应的空格内。
四、(本题包括2小题,共21分)
21.(9分)短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号_____________; D的原子结构示意图____________。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是____________________;
(3)A、B、C、D形成的化合物B2A2、CD2、D2A、DA2中.各原子都满足最外层8电子结构的是_______________________ (请填写具体的化学式)。
(4)CA2与D元素的单质在水溶液中反应的化学方程式是_________________________。
22.(12分)物质M、N、A、B、C、D、E、F、G、H,其中C、H为常见金属,且混合气体A在常温下不与空气接触时能发生如图所示变化(其他有关反应条件均略去):
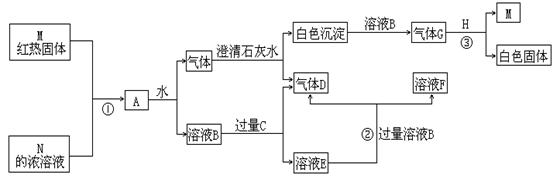
试回答:
(1)写出C、D和H的化学式: C:_____________;D_______________;H______________。
(2)写出反应①②③的化学方程式:
①____________________________________________________________。
②____________________________________________________________。
③____________________________________________________________。
五、(本题包括2小题,共18分)
23.(6分)实验测得某烃中碳元素的质量分数为91.3%,相对分子质量为92,则该烃的分子式为____________。若该烃为芳香烃,在其分子的“C-C”键或“H-C”键中
![]()
插入基团“ ”可形成六种含苯环的酯,请写出其中四种酯的结构简式:
__________________________________、____________________________________、
__________________________________、____________________________________。
24.(12分)化合物A是石油化工的一种重要原料,用A和水煤气为原料经下列途径合成化合物D(分子式为C3H6O3)。
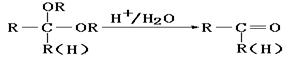
已知:
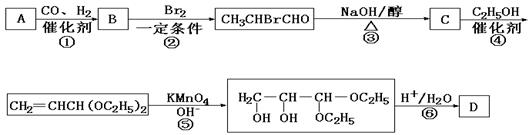
请回答下列问题:
(1)写出下列物质的结构简式:
A:__________;B:____________;C:_____________;D:___________。
(2)指出反应②的反应类型______________________。
(3)写出反应③的化学方程式___________________________________________。
(4)反应④的目的是___________________________________________________。
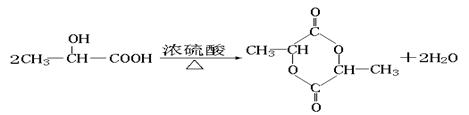
(5)化合物D’是D的一种同分异构体,它最早发现于酸牛奶中,是人体内糖类代谢的中间产物。D’在浓硫酸存在的条件下加热,既可以生成能使溴水褪色的化合物E(C3H4O2),又可以生成六原子环状化合物F(C6H8O4)。请分别写出D’生成E和F的化学方程式:
D’→E:___________________________________________________________。
D’→F:___________________________________________________________。
六、(本题包括2小题,共19分)
25.(5分)本题相对分子质量用以数据:Na2O 62.0 Na2O2 78.0 NaOH 40.0
(1)Na2O和Na2O2的混合物140mg和足量水作用,得到400mL溶液,其中含溶质160mg。
试计算原混合物中Na2O2的质量和所得溶液在常温下的pH。
26.(14分)将n mol木炭粉和1 mol氧化亚铁在反应器中混合,隔绝空气加强热。
(1)可能发生的化学反应有:
①2FeO+C====2Fe+CO2↑
②FeO+C====Fe+CO
③FeO+CO====Fe+CO2↑和④ 。
(2)若n<1/4,充分反应后,反应器中的固体物质是 ,气体产物是 。
(3)若n>4,充分反应后,反应器中的固体物质是 ,气体产物
是 。
(4)若反应的气体产物是混合物,n的取值范围是 。
(5)若反应的气体产物是混合物,且混合物中CO与CO2物质的量之比为2:1,则n的值为 。
参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | ||
| 答案 | A | C | D | D | C | D | C | C | ||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AC | C | A | D | B | AD | AB | B | AC | A |
19、(1)④①③②⑤
(2)玻璃棒 漏斗 烧杯
(3) 搅拌 引流 转移
20、(1)①无水硫酸铜 ②BC ③溶液不褪色或未完全褪色
(2)①BaCl2、NaCl 不能
②晶体D 加入的试剂B是过量的
③过量NaOH溶液(试剂B) Mg(OH)2 (固体C)
NaOH、Na2SO4 (晶体D) A、C (称量)
[其它合理答案也可以]
21、![]()
(1)O; (2)S2->O2->Na+
(3)Na2O2、SCl2、Cl2O
(4)SO2 +Cl2+2H2O=2HCl +2H2SO4
22、(1)C:Fe ;D:NO ;H:Mg 。
(2)①C+4HNO3=CO2↑+4NO2↑+2H2O[条件:△]
②3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O
③CO2+Mg=MgO+C[条件:点燃]
23、C7H8
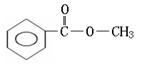
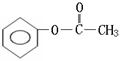
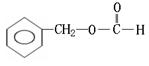
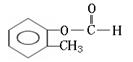 (邻、间、对)
(邻、间、对)
[以上六种任选四种]
24、(1)A:CH2=CH2 B:CH3CH2CHO
C:CH2=CHCHO D:CH2(OH)CH(OH)CHO
(2)取代
(3)CH3CHBrCHO+NaOH→CH2=CHCHO+NaBr+H2O[条件:醇/△]
(4)保护醛基,防止反应⑤时被高锰酸钾碱性溶液氧化
(5)
D’→E:CH3CH(OH)COOH→CH2=CHCOOH+H2O[条件:浓硫酸 /△]
D’→F:
25、PH=12
26. (1)C+CO2 2CO(2分)
(2)Fe、FeO(或名称)(1分。全对才得1分,下同);CO2(1分)
(3)F e、C(1分);CO(1分)
(4)![]() (2分)
(2分)
(5)![]() (2分)
(2分)