高三抽测第一学期化学卷
化 学 试 卷
本卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1~4页,第Ⅱ卷5~8页。全卷满分150分,考试时间120分钟。
注意事项:
1.答Ⅰ卷前,考生务必将自己的姓名、考试号、考试科目用2B铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其他答案,不能答在试题卷上。
3.考试结束后,将答案卡和第Ⅱ卷一并交回。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Cl-35.5 K-39 Ca-40 Fe–56
第I卷(选择题 共74分)
一.选择题(本题包括8小题,每小题4分,共32分。每小题只有一个选项符合题意。)
1.下列与“神舟六号”载人飞船有关的说法不正确的是
A.飞船的表面覆盖的一层石墨瓦之所以能起到保护作用是因为石墨能够耐高温
B.宇航员的食物做成大小可口的“一口酥”,目的是防止飞船内产生飘尘
C.飞船在宇宙中运行时,船舱内温度低、氧气少,无法划着火柴
D.在飞船上使用LiOH吸收多余的CO2而不使用NaOH
2. 下列各项中的“黄色”,不属于因化学反应而产生的现象的是
A.无色试剂瓶中的浓硝酸呈黄色
B.在硫化钠溶液中加入双氧水后有黄色沉淀生成
C.食盐在无色的火焰上灼烧时,火焰呈黄色
D.久置的碘化钾溶液呈黄色
3. 下列物质性质的变化规律与分子间作用力有关的是
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.金刚石的硬度大于硅的,其熔、沸点也高于硅的
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
4. 下列说法错误的是
A.盐与盐之间产生两种新盐的反应不一定是复分解反应
B.不活泼金属单质一定不能与比它活泼的金属的盐溶液反应
C.有的低沸点酸可以制取某些高沸点酸
D.酸与酸之间有的也能发生化学反应
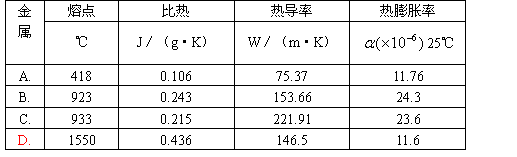
5. 用于火箭发动机、航天飞机制动闸的金属,要有良好的热学性能,比如熔点高,比热高,热导率高,适宜的热膨胀率等优异性能。根据下表,用于制动闸的最佳金属材料为
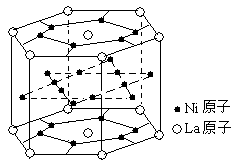
6.氢气是重要而洁净的能源,要利用氢气作能源,必须安全有效地储存氢气。有报道称某种合金材料有较大的储氢容量,其晶体结构的最小单元如右图所示。则这种合金的化学式为
A.LaNi6 B.LaNi3
C.LaNi4 D.LaNi5
7.向盛有NaHSO4溶液的烧杯中不断滴加Ba(OH)2溶液,随着Ba(OH)2的不断滴入,溶液中产生的沉淀量与溶液的PH变化情况正确的是
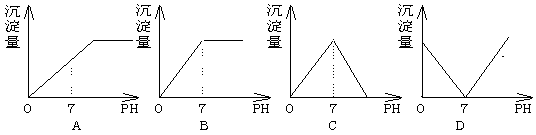
8.为检验某病人血液中的含钙量,现取10mL血液样品稀释后用草酸铵[![]() ]处理成草酸钙沉淀,将此沉淀溶于过量的稀
]处理成草酸钙沉淀,将此沉淀溶于过量的稀![]() 中,然后用
中,然后用![]() 溶液滴定(生成
溶液滴定(生成![]() 、
、![]() 、
、![]() )恰好消耗1.6mL,则该病人血液中含钙量为
)恰好消耗1.6mL,则该病人血液中含钙量为
A.2.4 g/L B.8 g/L C.6 g/L D.12 g/L
二.选择题(本题包括10小题,第9—16题每小题4分,第17—18题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个该小题就为0分。)
9. 下列说法正确的是
A.原子最外层电子数等于或大于3(小于8)的元素一定是主族元素
B.原子最外层只有1个电子的元素一定是IA族元素
C.最外层电子数比次外层电子数多的元素一定位于第二周期
D.某元素的离子最外层电子数与次外层相同,该元素一定位于第三周期
10. 下列事实不能用勒夏特列原理解释的是
A.三氯化铁溶液加热蒸干得到氧化铁
B.配制FeSO4溶液时加入铁粉防止氧化变质
C.在Fe(SCN)3 溶液中加入铁粉,振荡后颜色变浅
D.在氢氧化铁胶体中加入硫酸铁后出现沉淀
11. 已知某弱酸的二种酸式盐NaH2XO4和Na2HXO4,其中NaH2XO4溶液呈酸性,Na2HXO4溶液呈碱性。现有30℃时,浓度均为0.1 mol·L-1的NaH2XO4溶液和Na2HXO4溶液,两溶液中均存在的关系是
A.c(H+)·c(OH-)>1×10-14
B.c(H+)+2c(H3XO4) +c(H2XO4-)=c(XO43-)+c(OH-)
C.c(H+)+c(H3XO4)=c(HXO42-)+2c(XO43-)+c(OH-)
D.c(Na+)+c(H+)=c(H2XO4-) +c(OH-)+2 c(HXO42-)+3c(XO43-)
12. 若将224 mL标准状况下的Cl2通入5mL 2mol/L的FeBr2溶液中,发生反应的离子方程式是
A.Cl2+2Br-=Br2+2Cl- B.Cl2+2Fe2+=2Fe3++2Cl-
C.2Cl2+2Br-+2Fe2+=2Fe3++Br2+4Cl- D.3Cl2+4Br-+2Fe2+=2Fe3++2Br2+6Cl-
13.下列各组离子在指定溶液中,能大量共存的是
①无色溶液中:K+,Cl—,Na+,HPO42—,PO43—,SO42—
②PH=11的溶液中:CO32—,Na+,AlO2—,NO3—,S2—,SO32—,ClO—
③水电离出的H+浓度C(H+)=10—12mol·L—1的溶液中:Cl—,HCO3—,NO3—,NH4+,S2O32—
④加入铝能放出H2的溶液中:Mg2+,NH4+,Cl—,K+,SO42—,NO3—
⑤酸性溶液中:Fe2+,Al3+,NO3—,I—,Cl—,S2—
A.①②④ B.①②③ C.①② D.①
14.气态原子生成+1价气态阳离子所需要的能量称为第一电离能。元素的第一电离能是衡量元素金属性强弱的一种尺度。下列有关说法不正确的是
A.元素的第一电离能越大,其金属性越强
B.元素的第一电离能越小,其金属性越强
C.金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关
D.金属单质跟酸反应的难易,除跟该金属元素的第一电离能有关外,还与该单质中固态金属原子以及该金属原子失去电子后在水溶液里形成的水合离子的行为有关
15.下列叙述正确的是
A.某可溶物的摩尔质量大于18g/mol,则该物质饱和溶液的密度一定大于1g/cm3
B.氯化钠饱和溶液的质量分数为a%,该温度下氯化钠的溶解度为Sg,则a一定小于S
C.将质量分数分别为90%与10%的H2SO4等体积混合,其质量分数一定等于50%
D.饱和KCl溶液密度为ρg/cm3,物质的量浓度为c mol/L,则KCl的质量分数为(74.5c/1000ρ)×100%
16.原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中错误的是
A.由Al、Cu、稀硫酸组成的原电池,其正极反应式为:2H++2e-= H2↑
B.由Al、Mg、NaOH溶液组成的原电池,其负极反应式为:Mg-2e- = Mg2+
C.由Fe、Cu、FeCl3 溶液组成的原电池,其正极反应式为:Fe3++e- = Fe2+
D.由Al、Cu、浓硝酸组成的原电池,其负极反应式为:Cu-2e- = Cu2+
17.第VA族元素的原子(以R表示)与A原子结合形成RA3气态分子,其空间构型呈三角锥形。PCl5 在气态和液态时,分子结构如图所示,下列关于PCl5 分子的说法中不正确的是
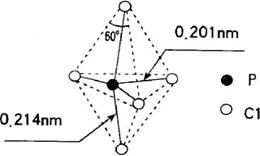 A.每个原子都达到8电子稳定结构
A.每个原子都达到8电子稳定结构
B.键角(∠ClPCl)有90o、120o、180o几种
C.PCl5 受热后会分解生成分子空间构型呈三角锥形的 PCl3
D.分子中5个P—Cl 键键能不都相同
18. 如图所示,温度不变时某容器分隔成A、B两部分,A、B之间挡板可以左右自由移动,
B有可移动的活塞,现在A中充入2molSO2和1molO2,在B中充入2molSO3(g)和lmolN2,
在相同温度和压强的条件下发生可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g)下列说法正确的是:
2SO3(g)下列说法正确的是:
 A.平衡后A、B两容器的体积比为1:2
A.平衡后A、B两容器的体积比为1:2
B. 平衡后A、B两容器中的SO3体积分数相等
C.平衡后A、B两容器中的SO2转化率相等
D. 平衡后容器中SO2的物质的量:A<B
 第II卷(非选择题 共76分)
第II卷(非选择题 共76分)
注意事项:
1.答题前请务必将密封线内的项目填写清楚。
2.答第II卷时,请用钢笔或圆珠笔直接写在试题卷上。
三、(本题包括2小题,共20分)
19.(6分)用32%~35%的FeCl3溶液腐蚀印刷线路铜板的废液中含有FeCl3 、FeCl2和CuCl2。
(1) 回收铜的化学方法为:
。
(2) 回收铜以后的溶液如何利用?
。
20.(14分)“烂版液”是制印刷锌版时,用稀硝酸腐蚀锌版后得到的“废液”。若产生的气体为N2O,稀硝酸腐蚀锌版反应的主要化学方程式是
。
“烂版液”另外含有由自来水带进的Cl-、Fe3+等杂质离子。
已知Fe3+开始沉淀的pH为2.7,沉淀完全的pH为3.7。
在实验室中,由“烂版液”制取ZnSO4·7H2O的过程如下:
① 在“烂版液”中逐渐加入6mol·L-1NaOH溶液,用pH试纸检验,至pH=8为止。
② 过滤后得到Zn(OH)2沉淀(该沉淀可溶于pH>8的溶液),用去离子水多次洗涤沉淀。
③ 用2mol·L-1的硫酸,慢慢将洗净的Zn(OH)2溶解,保持一定的pH,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
④ 溶液中注入2 mol·L-1的硫酸,使其pH保持为2,将溶液小心加热,冷却后即得到ZnSO4·7H2O晶体。
在操作①中保持pH=8的目的是 。
Cl-、NO3-是在操作 中除净的。
操作③中加热的目的是 。
Fe3+是在操作 中除去的。
操作④保持pH=2的目的是 。
操作④加热过程中所用的主要仪器是
。
四、(本题包括2小题,共16分)
21.(8分)位于短周期的四种主族元素A、B、C、D原子序数依次增大,已知A、C位于同一主族,A在周期表中原子半径最小。B、D的最外层电子数相等,且B、D的原子序数之和为A、C原子序数之和的两倍。根据你的推断回答下列问题:
(1)写出由上述元素形成的具有漂白作用的四种物质的化学式 、
、 。
(2)C与D形成D的最低价化合物的电子式: 。
(3)仅由B、C、D三种元素形成的一种盐,溶于水后呈碱性,请用一个离子方程式表示其呈碱性的原因: 。
22.(8分)现有浓度均为0.10mol/L的五种电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是 (填编号)
(2)将五种溶液稀释相同倍数时,其pH变化最大的是 (填编号)
(3)各取上述五种溶液25.00mL,分别滴加入0.10mol/L、25.00mL的HCl溶液,所得溶液pH最大的是 (填编号)。
实验中,量取25.00mLNaAlO2溶液可用 。
(4)将上述①②③④四种溶液两两混合,有一对溶液相互间能发生反应,写出该反应的离子方程式 。
五、(本题包括2小题,共20分)
23.(10分)A、B、C、D、E都是短周期元素,原子序数依次增大,B、C同周期,A、D同主族。A、B能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是______________________,
C元素在周期表中的位置是__________________。
⑵C和D的离子中,半径较小的是__________(填离子符号)。
⑶将D的单质投入甲中,待D消失后再向上述溶液中加入E的单质,此时发生反应的化学方程式是______________________________________________________。
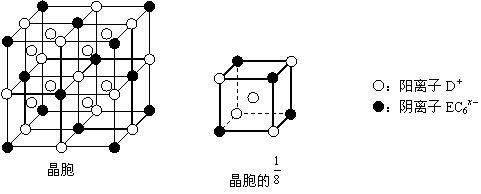
⑷C、D、E可组成离子化合物DxEC6,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子D+(用○表示)位于正方体的棱的中点和正方体内部;阴离子EC6x-(用●表示)位于该正方体的顶点和面心。
该化合物的化学式是____ _____。
 |
24.(10分)已知A、B、C、D、E为中学化学常见物质,A、B、C、D、E中均含有同一种元素,A、C均为气体,E为液体,下图中箭头上的反应物和反应条件均已略去。
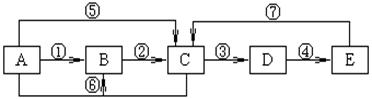
(1)当A与E发生化合反应时,能观察到空气中形成大量的白烟,则A、E共同含有甲元素。由此可知:E的化学式为 。
当小心加热A与E化合时的生成物F时,可得到一种无色无味的气体G(G和CO2具有相同的原子数目和电子数目,即G和CO2互称为等电子体)和一种无色无味的液体H,写出F分解生成G+H的化学方程式 _____ 。
(2)当A与E反应生成B和C时,则A、E共同含有乙元素。生成的C气体易液化。常温常压下D是气体,D被冰水冷却时变成无色晶体,此无色晶体的化学式是 。根据所学的氧化还原反应知识判断:在A~E各物质中,在一定条件下能与D发生氧化还原反应的物质有 (填字母)。D溶于纯净的E时,能按物质的量比1:1化合,生成物的化学式可表示为 (写成化合物、复合物或氧化物形式均可)。
六、(本题包括2小题,共20分)
25.(8分)1mol气态钠离子和1mol气态氯离子结合生成1mol氯化钠晶体释放出的热能为氯化钠晶体的晶格能。
(1)下列热化学方程中,能直接表示出氯化钠晶体的晶格能的是 。
A.Na+(g)+Cl-(g) NaCl(s);
△H B.Na(s)+1/2Cl2(g) NaCl(s); △H1
C.Na(s) Na(g); △H2 D.Na(g)-e- Na+(g); △H3
E.1/2Cl2(g) Cl(g); △H4 F.Cl(g)+e- Cl-(g); △H5
(2)写出△H1与△H、△H2、△H3、△H4、△H5之间的关系式
。
氧化亚铁晶体结构与氯化钠晶体结构相似,则:
(3)氧化亚铁晶体中,跟二价铁离子紧邻且等距的二价铁离子个数是 。
(4)设阿伏加德罗常数值为NA,若氧化亚铁的密度为![]() ,则氧化亚铁晶体中二价铁离子与氧离子之间最近距离是
cm(用代数式表示)
,则氧化亚铁晶体中二价铁离子与氧离子之间最近距离是
cm(用代数式表示)
(5)若氧化亚铁晶体中有3n个二价铁离子被2n个三价铁离子所替代,该晶体中氧离子的数目将______ (填“减少”、“增多”或“保持不变”)。
26.(12分)一定温度下,向一固定容积的密闭容器中加入2 mol A和1 mol B,发生下述反应:2A(g)+B(g)![]() 3C(g)+D(s);ΔH<0。达到平衡时生成了1.2 mol C。
3C(g)+D(s);ΔH<0。达到平衡时生成了1.2 mol C。
(1)在相同条件下,若向该容器中改为加入1 mol A、0.5mol B,要使平衡混合气体中各物质的百分含量与原平衡的相同,在D足量时,则还应加入________mol的物质C。
(2)若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.2 mol 。则D的起始物质的量n(D)应满足的条件是:
_ _________ ____。
(3)若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是
______________ ______________;
A、B、C、D四种物质相对分子质量之间的关系为___ _________ ______
(用MA、MB、MC、MD表示)。
(4)若将容器改为容积可变的容器,在相同温度下,压强为P0时,建立上述平衡之后,A的浓度为M mol/L。持续增大压强,当压强为3 P0时,A的平衡浓度为M1 mol/L;当压强为30 P0时,A的平衡浓度为M2 mol/L;当压强为300 P0时,A的平衡浓度为M3 mol/L。测得M1=3M,M2>30M,M3<300M。试解释形成这种结果的可能的原因:
①3 P0时:________________ ________,
②30 P0时:__________________ _____,
③300 P0时:__________________ ____。
参考答案
1、C 2、C 3、D 4、B 5、D 6、D 7、A 8、B
9、A C 10、B D 11、A D 12、C 13、D 14、A C 15、B D 16、B 17、A 18、D
19、(1) 加入铁粉CuCl2 + Fe = Cu + FeCl2; 过滤,在所得固体中加入稀盐酸溶解残余的铁,再滤出固体,洗涤得铜。(3分)
(2) 通入氯气 2FeCl2 +Cl2 = 2FeCl3 用于腐蚀印刷线路铜板。(3分)
20、 4Zn+10HNO3 = 4Zn(NO3)2+N2O↑+5H2O;(2分)
使生成的Zn(OH)2沉淀不溶解;(2分)
② ( 2分 );促使Fe3+完全水解为Fe(OH)3而除去;(2分)
③ ( 2分 ) ; 抑制Zn2+水解为Zn(OH)2;(2分)
蒸发皿,酒精灯,铁架台,玻璃棒。(2分)
21、(1) SO2 O3 H2O2 Na2O2 (各1分,共4分)
(2) (2分)
(3) SO32-+H2O ![]() HSO3-+OH-
(2分)
HSO3-+OH-
(2分)
22、(1) ④>②>①>③>⑤ (2分)
(2) ⑤ (2分)
(3) ①(1分)25mL或50mL 碱式滴定管 (25mL移液管)(1分)
(4)HCO3-+H2O+AlO2-=Al(OH)3↓+CO32- (2分)
23、⑴![]() (2分)
第二周期、第ⅦA族
(2分)
(2分)
第二周期、第ⅦA族
(2分)
⑵ Na(2分)
⑶ 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ (2分)
⑷ Na3AlF6 (2分)
24、(1)HNO3(2分), NH4NO3![]() N2O↑+2H2O(2分)
N2O↑+2H2O(2分)
(2)SO3(2分),A和B(2分),H2S2O7或H2SO4·SO3或2SO3·H2O(2分)
25、(1)A或△H (2分)
(2)△H1=△H+△H2+△H3+△H4+△H5 (2分)
(3)12(1分)
(4)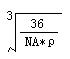 (2分)
(2分)
(5)保持不变(1分)
26、(1)任意 (2分)
(2)n(D)>0.6 mol(2分)
(3)当升高到一定温度以后,D渐渐转化为气态(2分)
2MA+MB==3MC+MD(3分)
(4)①气体物质两边的化学计量数相等,增大压强不改变平衡状态。(1分)
②B渐渐转化为非气态,增大压强平衡向左移动。(1分)
③C渐渐转化为非气态,增大压强平衡再次向右移动。(1分)