高三第二次模拟考试理科综合试卷化学试题
 6.2005年2月,我国政府就食用含有添加"苏丹红一号"色素的食品可能诱发癌症发出警告,并全面清剿苏丹红。"苏丹红一号"结构简式如右图。有关"苏丹红一号"的下列叙述中不正确的是
6.2005年2月,我国政府就食用含有添加"苏丹红一号"色素的食品可能诱发癌症发出警告,并全面清剿苏丹红。"苏丹红一号"结构简式如右图。有关"苏丹红一号"的下列叙述中不正确的是
A.分子式为C16H12N2O
B.能与浓溴水发生取代反应
C.与苏丹红一号官能团相同且苯环和萘环不直接相连的其它同分异构体有19种
D.因苏丹红一号中含有酚羟基,故可被空气氧化产生醛基
7.已知:H2O(g)=H2O(l);△H=-a KJ·mol-1
C2H5OH(g)=C2H5OH(l);△H=-b KJ·mol-1
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H=-c KJ·mol-1
在通常状况下,若使23g酒精完全燃烧并恢复到室温,放出的热量(单位:KJ·mol-1)为
A.a+b+c B.0.5(a+b+c)
C.0.5a-1.5b+0.5c D.1.5a-0.5b+0.5c
8.几种短周期元素的原子半径及主要化合价见下表:
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A.L、R的单质与稀盐酸反应的速率:L<R
B.M与T形成的化合物具有两性
C.Q、T与金属Na反应,产物的结构一定相同
D.L、Q形成的简单离子的半径:L>Q
9.中学化学教材中有大量数据,下列为某同学对数据的利用情况,其中不正确的是
A.用一定量NaOH稀溶液和稀盐酸反应测得的中和热数据,来推算一定量的稀H2SO4
和NaOH稀溶液反应的反应热
B.用沸点数据推测将两种液体混合物用蒸馏的方法分离开来的可能性
C.用反应热数据的大小判断不同反应的反应速率大小
D.用原子(或离子)半径数据推断某些原子(或离子)氧化性或还原性的强弱
10.某干燥粉末可能由Na2O、Na2O2、Na2CO3、NaHCO3中的一种或几种组成,将它与足量的盐酸反应有气体X逸出,X通过足量的NaOH溶液后体积缩小(同温同压下测定)。若将原混合粉末在空气中(不考虑空气中CO2参加反应)用酒精灯加热到再没有气体放出时,剩余固体质量大于原混合粉末质量。则对原混合粉末一定含有的物质的判断错误的是
A.Na2O B.Na2O2 C.NaHCO3 D.Na2CO3
11.一定条件下,可逆反应X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z起始浓度分别为c(X)、c(Y)、c(Z)(均不为0),平衡时X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断中不合理的是
2Z(g),若X、Y、Z起始浓度分别为c(X)、c(Y)、c(Z)(均不为0),平衡时X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断中不合理的是
A.c(X):c(Y)=1:3
B.平衡时,Y与Z的生成速率之比为3:2
C.X、Y的转化率不相等
D.c(X)的取值范围为0<c(X)<0.14mol·L-1
 12.某离子晶体的空间结构如图所示(正方体棱长为a cm)
12.某离子晶体的空间结构如图所示(正方体棱长为a cm)
关于该晶体的叙述正确的是
A.该晶体的化学式是M2N
B.晶体中与一个M距离最近的N有6个
![]() C.该晶体的密度是g·cm-3
C.该晶体的密度是g·cm-3
D.晶体中N与M间的最近距离为 a cm
13.分析某样品中氟化物(IF5)含量的方法是:先利用IF5与H2O发生水解反应生成HIO3,再用500mL 2mol·L-1 KI溶液与HIO3反应生成I2,最后用标准Na2SO3溶液滴定生成的I2。若用去100mL 3mol·L-1的Na2SO3溶液,则样品中IF5的含量是
A.0.05mol B.0.1mol C.0.2mol D.0.3mol
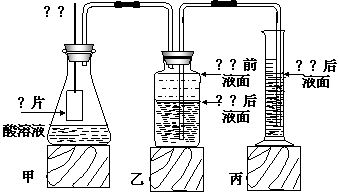 26.(14分)某研究性学习小组为探究在相同的温度和压强下,相同浓度相同体积的一元强酸和弱酸与足量铁片反应时,生成氢气的体积关系和速率关系,同时测定实验室条件下的气体摩尔体积。设计的简易装置如下图。(实验前后乙、丙装置中液面位置如图所示,实验前量筒内无液体)。该实验的主要操作步骤如下:
26.(14分)某研究性学习小组为探究在相同的温度和压强下,相同浓度相同体积的一元强酸和弱酸与足量铁片反应时,生成氢气的体积关系和速率关系,同时测定实验室条件下的气体摩尔体积。设计的简易装置如下图。(实验前后乙、丙装置中液面位置如图所示,实验前量筒内无液体)。该实验的主要操作步骤如下:
①配制浓度均为1 mol·L-1的盐酸和醋酸溶液;
②用 量取10.00mL 1mol·L-1盐酸和醋酸溶液分别加入到两个锥形瓶中;
下面是铁片与盐酸反应的实验操作。
③称取除去表面氧化膜的铁片a g,并系于铜丝末端,a的数值至少应该是
④在广口瓶中装入足量水,按图连接好装置,检查装置气密性;
⑤将铜丝向下移动,使铁片浸入盐酸溶液中至反应完全,需记录
⑥反应结束后待温度恢复到室温,读取量筒中水的体积前应 ,然后,准确读出量筒中水的体积为V mL。
请将上述步骤补充完整并回答下列问题:
(1)本实验中量筒应选用的规格为(填序号)
A.100mL B.200mL C.500mL
(2)将铜丝向下移动,使铁片浸入酸溶液中时,应注意的问题是 ,原因是 。
(3)忽略水蒸气的影响,在实验室条件下,气体摩尔体积的计算式为:
Vm=
(4)如果按相同的方法做醋酸与铁的反应实验,且操作准确无误,应得出结论是:
27.(20分)我国第二代身份证采用的是具有绿色环保性能的PETG新材料,PETG新材料可以回收再利用,且不构成任何污染。PETG的结构简式为:
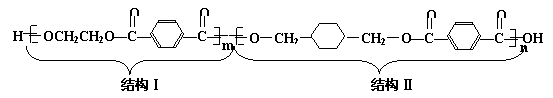
 已知:
已知:
(1)
(2)RCOOR1+R2OH=RCOOR2+R1OH(R、R1、R2表示烃基)
|
|
 |
|
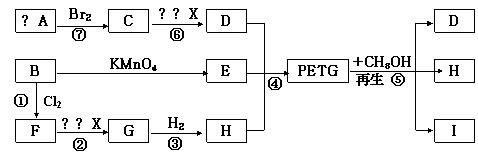
(1)反应②⑥加入的试剂X可以是(写化学式)
(2)⑤的反应类型是 反应;
(3)分别写出B、I的结构简式:B ,I ;
(4)写出下列反应的化学方程式:
反应③
反应⑥
(5)合成时应控制的单体的物质的量n(D):n(E):n(H)=
(用m、n表示)。
(6)用数学等式表示D、E、结构I三者的相对分子质量Mr(D)、Mr(E)、Mr(结构I)之间的关系。
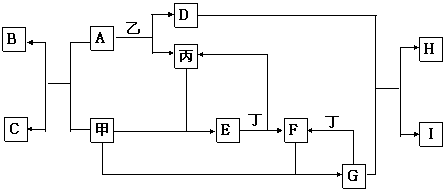
28.(11分)已知:甲、乙、丙、丁都是常见单质,且甲、丙在常温常压下为气体,A~I均是常见化合物;B、C中均含甲元素;H、I均不溶于水;将F溶液滴入B溶液时无明显现象,滴入C溶液时产生沉淀I。各物质(或它们的水溶液)之间有如下转化关系[在本题中:①反应所需要的水以及反应所产生的水均已略去,②所涉及的元素除丁的组成元素外,均为短周期元素]。
 |
请回答:
(1)A的电子式 ,I的化学式 。
(2)反应G+丁→F的离子方程式:
(3)H作为酸时,是 元酸,判断的依据是
(4)在反应C+F→I中,物质C所发生的反应的类型有
29.(15分)(1)0.02 mol·L-1的HCN溶液与0.02 mol·L-1 NaCN溶液等体积混合,已知该混合液中c(Na+)>c(CN-),用">、<、="符号填空。
①溶液中c(OH-) c(H+); ②c(HCN) c(CN-);
③c(HCN)+c(CN-)= mol·L-1.
(2)向明矾溶液中逐滴滴入氢氧化钡溶液至硫酸根离子刚好沉淀完全时,溶液的pH 7
(填>、<、=),离子方程式:
(3)已知0.1 mol·L-1 NaHA溶液的pH=2,则:
①0.1 mol·L-1 NaHA溶液中各种离子浓度由大到小的顺序是
②0.1 mol·L-1 H2A溶液中氢离子物质的量浓度[c(H+)]的取值范围是
(4)某温度下,水的离子积Kw=1×10-12,将该温度下由水电离产生的c(H+)=1×10-10 mol·L-1的H2SO4与同温度的pH=11的NaOH溶液按体积比9:1混合(忽略体积变化),则混合后该温度下溶液的pH=
化学试题答案及评分标准
选择题每题6分:6.D 7.D 8.B 9.C 10.D 11.C 12.D 13.B
26.共14分
②酸式滴定管(1分) ③0.28(2分) ⑤反应完成所需时间(或反应起止时间)(1分)
⑥移走量筒下面的木块,将量筒下移至量筒中液面与广口瓶中液面在同一水平面上(2分)
(1)B(2分)
(2)不能将铜丝浸入酸溶液中(1分),防止形成原电池,影响测定反应速率(1分)
(3)0.2V L·mol-1(2分)
(4)足量铁分别与同浓度、同体积盐酸和醋酸反应时,产生的氢气体积相同(1分),但反应速率是铁与盐酸反应快(1分)
27.(共20分,第(1)(2)(3)问每空2分,其余每空3分)
(1)NaOH溶液 (2)取代
 (3)B:
C:
(3)B:
C:
(4)③
⑥CH2Br-CH2Br+2H2O CH2OH-CH2OH+2HBr
(5)m:(m+n):n
(6)mMr(D)+mMr(E)=mMr(结构Ⅰ)+36m
28.(除第3问第1空1分外,其余每空均2分,共13分)
(1) Na+[:....:H]- Fe(OH)3
(2)2Fe3++Fe=3Fe2+
(3)一,与足量NaOH溶液反应的产物是NaAlO2(或写出该反应的化学方程式,或Al(OH)3的电离方程式等)
(4)还原反应,水解反应(复分解反应)
29.除第1问第1空1分外,其余每空2分,共13分。
(1)>,Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
(2)①> ②> ③0.02
(3)①c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
② 0.01 mol·L-1<c(H+)<0.11 mol·L-1