高三第二学期专题模拟考试化学试题(2)
命制时间:
一、选择题(本题包括9小题4分。每题只有一个选项符合题意)
1、关于氮族元素的叙述正确的是( )
A、稳定性:NH3>PH3 B、酸性:HNO3<H3PO4
C、它们单质的熔沸点依次升高 D、都有-3、+1、+3、+5价
2常温下,在0.1 mol·L-1 CH3COOH溶液中,水的离子积是 ( )
A.1×10-14 B.1×10-13.
C.1.32×10-14 D.1.32×10-15.
3、铝在人体中积累可使人慢性中毒,1989年世界卫生组织正式将铝确定为食品污染源
“之一而加以控制。铝在下列使用场合须加以控制的是.①制铝锭 ②制易拉罐 ③制
电线电缆 ④制牙膏皮 ⑤用明矾净水 ⑥制炊具 ⑦用明矾和苏打作食物膨化剂 ⑧用
氢氧化铝制药片治胃病 ⑨制防锈油漆 ( )
A.①②④⑤⑥⑦⑧ B.②⑤⑥⑦⑧
C.②④⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
4、下列溶液肯定呈酸性是( )
A、含H+的溶液 B、加酚酞显无色的溶液
C、pH<7的溶液 D、c(OH—)<c(H+)的溶液
5、能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是 ( )
A.向水中投入一小块金属钠 . B.将水加热煮沸.
C.向水中通入二氧化碳气体. D.向水中加食盐晶体
6、25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是 ( ).
A.1×10-7mol·L-1 B.1×10-12mol·L-1.
C.1×10-2mol·L-1 D.1×10-14mol·L-1.
7、把Ba(OH)2溶液滴入明矾溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是
A Al3+ B Al(OH)3
C AlO2- D Al3+和Al(OH)3
8、锌锰干电池在放电时,电池总反应方程式可以表示为:Zn+2MnO2+2NH4+ =
Zn2++Mn2O3+2NH3+H2O 在此电池放电时,正极(碳棒)上发生反应的物质是
A.Zn B.碳棒
C.MnO2和NH4+ D.Zn2+和NH4+
9、物质的量浓度相同的强酸和强碱以等体积相互反应后的溶液
A.一定呈中性 B.一定呈酸性
C.一定呈碱性 D.酸碱性无法判断
二、选择题(每小题4分,每小题有一个或两个选项符合题意;)
10、在CH3COOH![]() H++CH3OO-的电离平衡中,要使电离平衡右移且可采取的措施是
H++CH3OO-的电离平衡中,要使电离平衡右移且可采取的措施是
A、加入NaOH B、加入盐酸
C、加入NaAc D、加热
11、将两份质量相等的铝粉,分别加入足量的氢氧化钠和足量的稀硫酸溶液中,则它们放出的气体(相同条件下)的体积比为 ( )
A.1∶1 B.1∶2
C.1∶3 D.2∶3
12、将10 mL0.1 mol·L-1氨水与10 mL0.2 mol·L-1盐酸混合后,溶液中各种离子的物质的量浓度由大到小的顺序是
A、c(Cl-)>c(H+)>c(NH4+)>c(OH-) B、c(Cl-)>c(NH4+)>c(H+)>c(OH—)
C、c(NH4+)>C(Cl-)>c(OH-)>c(H+) D、c(H+)>c(Cl-)>c(NH4+)>c(OH-)
13、用某种仪器量一液体体积时,平视读数为V1mL,仰视读数为V2mL,俯视读数为V3mL,若V3>V1>V2,则所使用仪器可能是
A、容量瓶 B、量筒
C、碱式滴定管 D、以上仪器均可
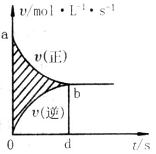 14、在容积为4 L的刚性密闭容器中.进行可逆反应:
14、在容积为4 L的刚性密闭容器中.进行可逆反应:
X (g) + 2Y(g)![]() 2Z(g)并达到平衡在此过程中以
2Z(g)并达到平衡在此过程中以
Y的浓度改变表示的反应速率v(正)、v(逆)与时间t的关
系如图示,则图中阴影部分的面积表示
A、X的浓度的变化 B、Y的浓度的变化
C、Z的浓度的变化 D、Y的物质的量的减少
15、反应速率V和反应物浓度的关系是用实验的方法测定的,化学反应:H2+Cl2=2HCl的反应速率V可以表示为:v=k(C![]() )m (C
)m (C![]() )n,式中的k为常数,m和n的值以可用下列表中数据确定之。
)n,式中的k为常数,m和n的值以可用下列表中数据确定之。
| C | C | V(mol/L·S) |
| 1.0 | 1.0 | 1.0k |
| 2.0 | 1.0 | 2.0k |
| 2.0 | 4.0 | 4.0k |
由此可以推得,m和n的值正确的是
A、m=1
,n=2
B、m=![]() 、n=
、n=![]()
C、m=![]() ,
n=1
D、m=1 ,n=
,
n=1
D、m=1 ,n=![]()
16、在密闭容器中发生反应2SO2 (g) + O2(g) ![]() 2SO3(g),起始时SO2和O2分别为20mol 和10mol,达到平衡时,SO2的转化率为80%,若从SO3开始进行反应,在相同条件下,欲使平衡时各成分的的体积分数前者相同,则起始时SO3的物质的量,平衡时SO3的转化率分别为
2SO3(g),起始时SO2和O2分别为20mol 和10mol,达到平衡时,SO2的转化率为80%,若从SO3开始进行反应,在相同条件下,欲使平衡时各成分的的体积分数前者相同,则起始时SO3的物质的量,平衡时SO3的转化率分别为
A、10mol、10% B、20mol、20%
C、10mol、40% D、20mol、80%
17、相同温度下,中和10mLpH=10的氨水,需pH=2的盐酸![]() mL,若中和10mLpH=11的氨水,需pH=1的盐酸
mL,若中和10mLpH=11的氨水,需pH=1的盐酸![]() mL,则
mL,则![]() 和
和![]() 的关系是
的关系是
A.![]() <
<![]() B.
B.![]() =
=![]()
C.![]() >
>![]() D.
D.![]() =0.1
=0.1![]()
18、反应NO + O2 + NO2 + H2O → HNO3(未配平)是一个有多组计量数(即系数)的化学方程式,当O2有1/3被NO还原时,此反应各物质的化学计量数为 ( )
A、4,9,24,14,28 B、1,1,1,1,2
C、8,9,12,10,20 D、任意数均可
(可能用到的相对原子质量Ba 137 S 32 O 16 H 1 C 12 I 127 Cl 35.5)
高三第二学期专题模拟考试(2)
化学试题
(答卷)
一、选择题
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
三、填空题(本题包括2小题,共15分)
19、(7分)试管中盛有少量白色晶体,可能是铵盐,检验的方法是:__________________________________________________________________________________________________________________________________________(4分)。写出有关的离子方程式___________________ (3分)。
20、(8分)某可溶性盐的化学式XmYn(m≠n),将一定量的该盐溶于适量的水中。
(1)若测得溶液的pH为4,则该盐与水反应的离子方程式可能为:
(2)若该盐水溶液的pH为10,则该盐与水反应的离子方程式可能为:
21、有一包固体混合物,可能含有氯化铁、硫酸铜、碳酸钠、氯化钙、硝酸钠、氯化钾中的一种或几种,现做如下实验:
(1) 将混合物放入足量水中,得无色溶液
(2) 在上述溶液中加入足量盐酸,有气泡
(3) 在上述完全反应后的溶液中滴加硝酸银溶液,有白色沉淀,则原混合物中一定有 ,一定没有
可能有 。
四、实验题(本题包括2小题,共25分)
22、(6分)(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是________mL。
(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL
B.是(50-a)mL
C. 一定大于amL
D.一定大于(50-a)mL
23、(19分)选择使用图中仪器(含药品).验证由铜和适量浓硝酸反应产生的气体中含有NO(N2和O2的用量可自由控制)。(每空2分)
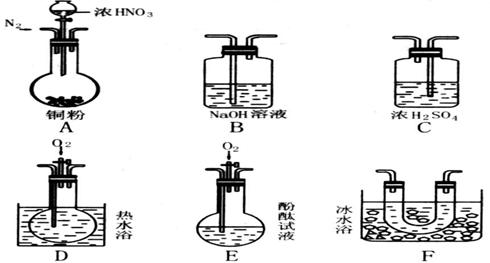
已知:①NO+NO2+2OH—=2NO2— + H2O,②气体液化温度:NO2:21℃,NO:—152℃(1)现有甲、乙、丙三位同学分别设计了以下三个实验方案(用仪器的连接顺序表示)。
甲:A→C→F→D→B
乙;A→B→C→E
丙;A→F→D→B
甲、乙、丙三位同学提出的实验方案是否能验证Cu与适量浓HNO3反应产生的气体中含有NO(填“能”或“不能”)
甲 ,乙 ,丙 。
具体说明不能验证的主要原因(若三个实验方案都能验证,则此小题不用回答):
甲方案: ;乙方案: ;丙方案: 。
(2)反应前应先通人足量的N2,其目的是 。
(3)确认气体中含有NO的现象是 。
(4)如果O2过量,则装置B中发生反应的离于方程式:
。(3分)
五、计算题(本题包括2小题,共22分)
24、(10分)500molPH=1的稀硫酸和HCl的混合液与50mlBa(OH)2,充分反应后过滤,得沉淀0.466g,溶液的PH值变为13,求:
①原混合液中的SO42-、Cl-的物质的量浓度(5分)
②Ba(OH)2溶液的物质的是浓度
25、(12分)将3molA气体与2 molB气体在2 L容器中混合并在一定条件下发生如下反应:
2A(g) + B(g) ![]() 2C(g)。达到平衡后测得容器内压强减小了28%,试计算:
2C(g)。达到平衡后测得容器内压强减小了28%,试计算:
(1) C的物质的量浓度;(2)A、B的转化率。
参考答案
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| A | A | C | D | C | B | C | C | D |
| 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| AD | A | A | B | AB | D | B | A | C |
19、(1)略
(2)NH4+ + OH- == NH3 ↑ + OH-
20、(1) Xn+
+ n H2O ![]() X(OH)n
+ n H+ (2) Ym-
+ H2O
X(OH)n
+ n H+ (2) Ym-
+ H2O ![]() HY(m-1)-
+ OH—
HY(m-1)-
+ OH—
21、碳酸钠; 氯化铁、硫酸铜、氯化钙; 硝酸钠、氯化钾
22、(1)3.2 (2)D
23、(1)能、不能、不能、乙不能是因为NO与NO2一起被碱液吸收了;丙不能是因为冷凝时NO2与H2O反应生成NO;
(2)除去反应容器中的O2
(3)瓶中出现红棕气体
(4)4NO2 + O2 + 2H2O == 4H+ + 4NO3-
24、(1)c (H2SO4)==0.04 mol/L (2) c (Ba(OH)2) == 0.6 mol/L
25、(1)C的物质的量浓度为1.4 mol/L (2)A的转化率为93.3%;B的转化率为70.0%