高三第一次调研考试化学试卷
考试时间 120分钟 总分 150分
第(Ⅰ)卷
可能用到的原子量:H-1 C-12 N-14 O-16 Na-23 Fe-56 S-32 Cu-64 Ag-108
一、选择题(每小题只有一个正确答案,每题4分,共32分)
1.下列叙述正确的是
A.发生化学反应时失去电子越多的金属原子,还原能力越强
B.金属阳离子被还原后,一定得到该元素的单质
C.核外电子总数相同的原子,一定是同种元素的原子
D.能与酸反应的氧化物,一定是碱性氧化物
2.根据表中给出的几种物质的熔、沸点数据,判断下列有关说法中错误的是
| NaCl | AlCl3 | SiCl4 | 单质B | |
| 熔点 | 810℃ | 190℃ | -68℃ | 2300℃ |
| 沸点 | 1465℃ | 183℃ | 57℃ | 2500℃ |
A.SiCl4形成的是分子晶体 B.单质B可能是原子晶体
C.电解NaCl水溶液可制得金属钠 D.不能用电解熔化AlCl3制取单质铝
3.下列叙述中,不正确的是
①原子晶体中只含有极性键 ②金属在常温时都以晶体形式存在
③离子晶体一定含离子键,也可能有共价键
④分子晶体中一定有分子间作用力,有的还可能有氢键
A.①④ B.②③ C.①② D.①③
4.已知如下两个热化学方程式:
2CO(g)+O2(g)===2CO2(g);△H==-566kJ/mol
CH4(g)+2O2(g)==CO2(g)+2H2O(1);△H=-890kJ/mol
由1molCO 和3molCH4组成的混合气在上述条件下完全燃烧时,释放的热量为
A.2912kJ B.2953kJ C.3236kJ D.3867kJ
5.R2O8n-离子在一定条件下可以把Mn2+离子氧化成MnO4-,若反应后R2O8n-离子变为RO42-离子。又知反应中氧化剂与还原剂的物质的量之比为5:2,则n的值是
A.1 B.2 C.3 D.4
6、某溶液中存在较多的K+、H+、I-,下列离子可以在上述溶液中大量共存的是
A.Cl-、NH4+、Na+ B.H3O+、Cl-、NO3-
C.Na+、HCO3-、SO42- D.HCOO-、Br-、NH4+
7.下列四个实验中肯定有错误的是
①有一瓶澄清溶液,作离子鉴定时得出结论时含有Fe3+、Na+、Cl-和CO32-
②某固体混合物溶于水后检验出含K+、NO3-、Na+和Cl-,则该固体混合物可能是硝酸钾和氯化钠或硝酸钠和氯化钾的混合物
③固体氢氧化纳部分吸收了空气中的二氧化碳并溶于水后,溶液中含较多的HCO3-
④配制FeCl3溶液时,常将FeCl3固体溶于较浓的盐酸中,然后再用蒸馏水稀释到所需浓度
A、①② B、①③ C、②③ D、②④
8.下列实验操作正确的是
A.从试剂瓶中取出的任何药品,若有剩余均不能再放回原试剂瓶
B.在中和滴定的实验过程中,目光应注视滴定管中的液面
C.用10mL量筒量取6.4mL稀盐酸
D.称取一定量NaOH固体放入量筒中加水溶解
二、选择题(每小题有1-2个正确答案,每题4分,共40分)
9.t℃时,将100 g某物质A的溶液蒸发掉10 g水,恢复至t℃,析出2.5 g晶体;再蒸发掉10 g水,恢复至t℃,析出7.5 g晶体。下列说法中正确的是
A.t℃时原溶液是不饱和溶液 B.若A是CuSO4,则7.5 g晶体中含水2.7 g
C.t℃时A的溶解度为75 g D.原溶液中A的质量分数为40%
10.氢氧燃料电池以铂作电极,KOH溶液作电解质溶液。对该电池的说法正确的是
A.负极反应为O2+2H2O+4e-===4OH-
B.电池工作时,正极区pH升高
C.电池工作时溶液中的阴离子移向正极
D.电池的总反应为:2H2+O2===2H2O
11.用盐酸、氢氧化钠溶液、氨水中的任意一种试剂,均可被鉴别的一组物质是 A.碳酸钠与氯化钠 B.硫酸铝与硝酸银
C.硝酸铵与氯化镁 D.硫酸亚铁与氯化亚铁
12.设NA为阿伏加德罗常数。下列叙述正确的是 A.常温下,1molNaHCO3投入足量稀盐酸中,待反应结束后,可逸出NA个CO2分子
B.在含有NA个CH3COO-的醋酸溶液中, H+数目略大于NA
C.1molCH3+(碳正离子)中含电子数目为10NA
D.46gNO2和N2O4混合气体中含有原子数为3NA
13.要除去氢气中混有的二氧化碳、氯化氢和水蒸气,操作步骤最简便的是下列选项中的:①通过盛有浓硫酸的洗气瓶 ②通过盛有水的洗气瓶 ③通过盛有氢氧化钠溶液的洗气瓶 ④通过装有灼热氧化铜的玻璃管 ⑤通过装有P2O5的玻璃管 ⑥通过装有碱石灰的干燥管
A.②③① B.②③⑤ C.③⑤ D.⑥
14.在实验室进行物质制备,下列从原料及试剂分别制取相应的最终产物的设计中,
![]()
![]()
![]() 理论上正确、操作上可行、经济上合理的是
理论上正确、操作上可行、经济上合理的是
A.C CO CO2 Na2CO3
![]()
![]()
B.Cu Cu(NO3)2溶液 Cu(OH)2
![]()
![]() C.Fe
Fe2O3
Fe2(SO4)3溶液
C.Fe
Fe2O3
Fe2(SO4)3溶液
![]()
![]() D.CaO
Ca(OH)2溶液
NaOH溶液
D.CaO
Ca(OH)2溶液
NaOH溶液
15.下列离子下方程式不正确的是
![]() A.碳酸钠溶液呈碱性:CO32-+H2O HCO3-+OH-
A.碳酸钠溶液呈碱性:CO32-+H2O HCO3-+OH-
B.将少量二氧化硫气体通入次氯酸钠溶液:SO2+2ClO-+H2O=SO32-+2HClO
C.氯化铝溶液中加入过量氨水:Al3++4NH3·H2O=AlO2-+4NH4+
D.氯气通入澄清石灰水中:Cl2+2OH-=Cl-+ClO-+H2O
16.常温下用石墨电极,电解1000 mL 0.1 mol·L-1 Cu(NO3)2和0.1 mol·L-1 AgNO3组成的混合溶液,当某一电极上生成的气体在标准状况下体积为1.12 L时,假设溶液体积不变,下列说法正确的是
A.阴极增重1.4 g B.所得溶液 pH<1
C.阴极增重0.64 g D.所得溶液pH>1
17.使a g Fe粉与一定量的硝酸溶液充分反应(Fe粉完全溶解),生成的气体与标准状
况下b L O2混合后,恰好能被水完全吸收,a和b的关系可能是
A、b ≥0.3a B、b ≤0.2a C、0.2a ≤b ≤0.3a D、无法确定
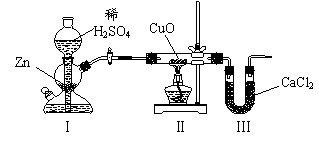 18.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是
18.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是
A.Ⅰ、Ⅱ装置之间缺少干燥装置 B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝 D.CuO没有全部被还原
高三第一次调研考试
化 学 试 卷
一、二、选择题(共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| 答案 |
| |||||||||
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
第(Ⅱ)卷(共78分)
三、本大题共三小题(共 32 分)
19.(10分)回答下列问题:
(1)下列仪器中:①普通漏斗 ②天平 ③蒸馏烧瓶 ④容量瓶 ⑤燃烧匙 ⑥滴定管 ⑦分液漏斗,常用于物质分离的是__________(填编号),其中根据物质沸点不同分离物质的仪器是______________(填编号)。
(2)实验室有贮存以下物质的方法:A少量白磷贮存在水中;B碳酸钠溶液贮存在带玻璃塞的玻璃瓶中;C少量金属钠贮存在酒精中;D浓硝酸贮存在棕色的细口玻璃瓶中。其中正确的_______________________(填编号)。
(3)下列实验操作错误的是___________
A.检测溶液pH的操作是:将湿润的pH试纸置于表面皿上,用玻璃棒蘸取溶液,点在pH试纸的中部,与对应的标准比色卡进行比较。
B.中和滴定实验中,锥形瓶内有少量蒸馏水会造成测定结果偏低。
C.制备硫酸亚铁晶体时,向稀硫酸中加入废铁屑至有少量气泡发生时,过滤,然后加热蒸干滤液即可得硫酸亚铁晶体。
D.向2mLl0%NaOH溶液中滴入2%CuS04溶液的4—6滴,振荡后加入乙醛溶液0.5mL,加热至沸腾,则有红色沉淀出现。
E.在进行硫酸铜晶体里结晶水含量的测定实验中,称量操作至少要进行4次。
20.(10分)某课外活动小组的同学,在实验室研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题。
(1)这样制取的二氧化硫气体中可能含有的杂质是 。
(2)某同学用下列装置连接成一整套实验装置以验证(1)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是 (用a、b……填写)。
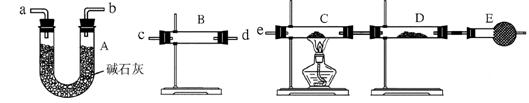
(3) 根据(2)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B |
|
|
|
| C | CuO固体 |
|
|
 21.(12分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出四个可以生成H2的反应:①Zn+盐酸
②Na+水
③Al+NaOH溶液 ④Na+无水乙醇。为点燃上述四个反应生成的H2,他们设计了如下装置图:
21.(12分)某实验小组对中学课本中可生成氢气的反应进行了研究,总结出四个可以生成H2的反应:①Zn+盐酸
②Na+水
③Al+NaOH溶液 ④Na+无水乙醇。为点燃上述四个反应生成的H2,他们设计了如下装置图:
请回答下列问题:
⑴写出Na与H2O反应的化学方程式 ;
⑵在点燃H2之前必须先进行 ,方法是
;
⑶实验小组在点燃用上述装置制得的H2时,①③④实验获得成功,②却失败了。他们分析认为失败的原因是Na与H2O的反应速率太快,Na的用量太少。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是 。
⑷实验小组查阅钠、苯、水的密度分别为0.97g/mL、0.88g/mL、1.00g/mL,并据此对实验进行了改进。
![]()
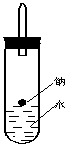
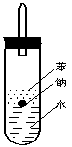
原实验 改进后实验
在改进后的实验中H2的生成速率减慢。原因是
。
四、本大题共三小题(共 28 分)
22.(8分)为防止碘缺乏病,,通常在食盐中加入KIO3。
⑴用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程式是_______________________________________,若要确认食盐中还含有K+,方法是 。
⑵工业上以石墨和铁为电极电解KI溶液制取KIO3。电解时,石墨作_________(填“阳极”或“阴极”),石墨电极上的电极反应式是 ,电解过程中铁电极附近溶液pH__________(填“变大”、“变小”或“不变”)。
23.(10分)如图所示,甲、乙、丙是三种常见单质,X、Y、Z是常见化合物。它们之间有如下转化关系:
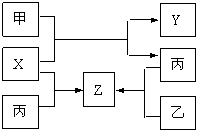 (1)若甲是短周期金属单质,乙、丙是短周期非金属单质。X、Y、Z中只有一种是离子晶体,试推断:
(1)若甲是短周期金属单质,乙、丙是短周期非金属单质。X、Y、Z中只有一种是离子晶体,试推断:
①含有丙元素的化合物是 (填X、Y、Z)
②工业上有些气体中也含有一定量的Z成分,试列举工业上含Z成分的气体 。
③X与甲反应的化学方程式 。
(2)若甲是具有氧化性的黄绿色气体单质,丙通常状况下是深红棕色液体,Y和Z具有相同的阳离子,X与Z含有相同的阴离子,试推断:
①写出甲、乙、丙三种物质的化学式 、 、 。
②写出X与足量的甲在溶液中完全反应的离子方程式
。
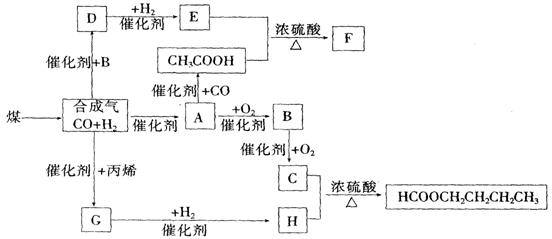 24.(10分)
煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:
24.(10分)
煤的气化和液化是使煤变成清洁能源的有效途径。煤气化的主要反应是:
|
(1)写出下列物质的结构简式:
A______________ ____、H_____________________;
指出A和H的关系____ 。
(2)写出下列反应的化学方程式:
D与新制Cu(OH)2共热 _____________________ ________
E→F ___________________________________________________________
五、本大题共三小题(共 分)
25.(7分)工业甲醇的质量分数可以用下列方法测定:
①在稀H2SO4中甲醇被Cr2O72—氧化成CO2和H2O,反应式为:
CH3OH+Cr2O72—+8H+=CO2↑+2Cr3++6H2O;
②过量的Cr2O72—可用Fe2+与之完全反应:
_____Cr2O72—+_____Fe2++_____H+ ——_____Cr3++______Fe3++______H2O
现有0.12 g工业甲醇,在H2SO4溶液中与25 mL 0.2 mol·L-1K2Cr2O7溶液反应,多余的K2Cr2O7再用1 mol·L—1FeSO4与其反应,结果用去FeSO4溶液9.6 mL。
①配平第②步中离子方程式。 ②计算工业甲醇的质量分数。
26. (11分)有三份不同质量比的氧化铜与炭粉的混合物样品①、②、③。甲、乙、丙三位同学各取一种样品,加强热充分反应,测定各样品中氧化铜的量。
(1)甲取样品①强热,若所得固体为金属铜,将其置于足量的稀硝酸中微热,产生1.12L气体(标准状况),则样品①中氧化铜的质量为_____ _____g。
(2)乙取样品②a g 强热,生成的气体不能使澄清石灰变浑浊。再将反应后的固体与足量的稀硝酸微热,充分反应后,有b g固体剩余,该剩余固体的化学式为___ ____。样品②中氧化铜质量为______ _____g (用含a、b的代数式表示)。
(3)丙称量样品③强热后剩余的固体,质量比原样品减小了c g,若该固体为金属铜,则样品③中氧化铜物质的量(n)的取值范围为________ 。
高三第一次调研考试
化学试卷答案
一、二、选择题(共72分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| |
| 答案 | C | C | C | B | B | A | B | C |
| |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| 答案 | AB | BD | B | BD | D | D | BC | B | C | D |
三、本大题共三小题(共 32 分)
19、(10分)(1)①③⑦ ③(2)AD (3)ABC
20、(10分)(1) 氢气和水蒸气 (2)c d (或d c) a b (或b a) e
(3)
| 装置 | 所盛药品 | 实验现象 | 结论或解释 |
| B | 无水硫酸铜 | 固体由白色变成蓝色 | SO2中含有水蒸气 |
| C | 固体由黑色变成红色 | SO2中含有氢气 |
21、(12分)⑴2Na+2H2O=2NaOH+H2↑
⑵验纯,用向下排气法收集一试管氢气,用拇指堵住,移近火焰,移开拇指点火。若听到轻微的“扑”声,则表明H2纯净。
⑶较多的钠与水反应放出大量的热,使试管内H2与O2的混和气点燃而爆炸。
⑷钠比水轻,比苯重,落在苯水交界处。钠与H2O反应产生的H2使钠浮起,脱离水面,反应停止;当钠表面的H2逸出,钠又回落,与水反应,如此反复,就可减慢Na与H2O反应速度。
四、本大题共三小题(共 28 分)
22、(8分)⑴IO3-+5I-+6H+=3I2+3H2O 取食盐做焰色反应实验,若透过蓝色钴玻璃观察焰色呈紫色,说明有K+(答取上述反应后溶液进行实验不给分) (4分)
⑵阳极 I-+3H2O-6e-=IO3-+6H+ 变大 (4分)
23、(10分)⑴①X、Z ②水煤气等
③2Mg+CO2 2MgO+C
(2)①Cl2 Fe
Br2 ②2Fe2++4Br-+3Cl2 2 Fe3++2Br2+6Cl-
24、(10分)(1) CH3OH CH3CH2CH2CH2OH; 同系物
|
|
![]() HOCH2CH2OH +CH3COOH CH3COOCH2CH2OOCCH3
+2H2O
HOCH2CH2OH +CH3COOH CH3COOCH2CH2OOCCH3
+2H2O
五、本大题共三小题(共 18 分)
25、(7分)⑴1、6、14、2、6、7
⑵由反应②可知,反应①剩余的n(Cr2O72—)=![]() n(Fe2+)=0.0016 mol
n(Fe2+)=0.0016 mol
反应①消耗的n(Cr2O72—)=0.0050 mol-0.0016 mol=0.0034 mol
则n(CH3OH)=0.0034 mol
w(CH3OH)=![]() ×100%=90.7%
×100%=90.7%
26、(11分)
(1)6
(2)C 20/23(a-b)
(3)C/28≤n≤C/22