高三第一次月考-----化学试题
可能用到的原子量:H 1 He 4 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Mn 55 Fe 56 Zn 65 Br 80 Ag 108
第Ⅰ卷(选择题共60分)
一、选择题(本题包括20小题,每小题3分,共60分。每小题只有一个选项符合题意)
1.下列各项表达式正确的是
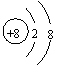 (A) O2―的结构示意图:
(B) Na2S的电子式:
(A) O2―的结构示意图:
(B) Na2S的电子式:![]()
(C) 甲醛的结构简式:CH2O
(D) 氮分子的结构式:![]()
2、X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
3、能正确表示下列化学反应的离子方程式是
A 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O=2HCO3-+SO32-
B.碳酸氢钠溶液与少量石灰水反应 HCO![]() + Ca2+ + OH—
= CaCO3↓ + H2O
+ Ca2+ + OH—
= CaCO3↓ + H2O
C 氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓
D 次氯酸钙溶液中通人过量二氧化碳:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
4、2005年8月以来,各地不断出现大规模成品油紧缺现象,广东部分加油站甚至“闭门谢客”,继“电荒”之后,“油荒”又至。石油资源的短缺制约着多个行业的发展。针对这一现象,某学习小组提出如下应对方案,你认为不够科学合理的是
A、采用电解水法制取无污染的氢能 B、完善煤液化制汽油的技术
C、研制推广以甲醇为燃料的汽车 D、进一步提高石油加工工艺
5、下列反应离子方程式正确的是
A、向氯化铝溶液中加入过量烧碱溶液:Al3+ + 4OH- = AlO2- + H2O
B、向苯酚钠溶液中通入二氧化碳:CO2 + H2O + C6H5O- → C6H5OH +HCO3-
C、向小苏打溶液中加入醋酸溶液:HCO3- + H+ = CO2↑+ H2O
D、向溴化亚铁溶液中通入过量氯气:Fe2+ + 2Br - + 2Cl2= Fe3+ +Br2 + 4Cl -
6、纳米材料的表面微粒数占总微粒的比例极大,这是它具有许多特殊性质的原因。假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同。则这种纳米颗粒的表面微粒数占总微料粒数的百分数为 ( )
A.87.5% B.92.9% C.96.3% D.100%
7、根据中央电视台报道,近年来,我国的一些沿江或沿海城市多次出现大雾天气致使高速公路关闭,航班停飞,雾属于下列分散系中的( )
(A)溶液 (B)悬浊液 (C)乳浊液 (D)胶体
8、在反应5NH4NO3![]() 2HNO3+4N2↑+9H2O中,被氧化的氮原子与被还原的氮原子的物质的量之比为
2HNO3+4N2↑+9H2O中,被氧化的氮原子与被还原的氮原子的物质的量之比为
A、3 :5 B、5 :3 C、5 :8 D、5 :4
9、下列关于晶体的叙述中,不正确的是
A、金刚石网状结构中,由共价键形成的碳原子环中,最小的环上有6个碳原子
B、氯化钠晶体中,每个Na+周围距离相等的Na+共有6个
C、氯化铯晶体中,每个Cs+周围紧邻8个Cl-
D、干冰晶体中,每个CO2分子周围紧邻12个CO2分子
10、下列说法正确的是
A、在101kPa时,1molC与适量O2反应生成1molCO时,放出 110.5kJ热量,则C的燃烧热为110.5kJ/mol
B、在101kPa时,1molH2完全燃烧生成液态水,放出285.8kJ热量,H2燃烧热为-285.8kJ/mol
C、N2的化学性质比O2稳定的原因可用共价键的强度来解释
D、在稀溶液中:H+ (aq) + OH-(aq) === H2O(l);△H= -57.3kJ/mol,若将含0.5molH2SO4的浓硫酸与含1molNaOH的溶液混合,放出的热量等于57.3kJ
11、下列晶体分类中正确的一组是( )
| 离子晶体 | 原子晶体 | 分子晶体 | |
| A | NaOH | Ar | SO2 |
| B | H2SO4 | 石墨 | S |
| C | CH3COONa | 水晶 |
|
| D | Ba(OH)2 | 金刚石 | 玻璃 |
12、根据等电子原理:由短周期元素组成的微粒,其原子数相同,且各原子最外层电子数之和也相同,可互称为等电子体,它们具有相似的结构特征。以下各组微粒结构不相似的是:
A、CO和N2 B、O3和SO2 C、N2H4和C2H4 D、CO2和N2O
13、下列叙述中的四种非金属元素,所形成的气态氢化物的稳定性最差的:
A、构成矿物和岩石的主要元素 B、空气中质量分数最高的元素
C、单质在常温下呈液态的元素 D、形成化合物种类最多的元素
14、下列变化过程中,无化学键断裂或生成的是( )
A.石墨转化为金刚石 B.NaCl晶体溶于水 C.干冰升华 D.HCl溶于水
15、下列分子中,属于含有极性键的非极性分子是 ( )
A.H2O B.Cl2 C.NH3 D.CCl4
16、某无色透明溶液滴加甲基橙后,呈红色,在该溶液中能大量共存的离子组是( )
A.K+、Na+、MnO4—、NO3— B.NH4+、Mg2+、K+、SO42—
C.Ca2+、Ba2+、NO3—、Cl— D.Ba2+、Zn2+、CH3COO—、Cl—
17、在体积可变的密闭容器中,反应mA(气)+nB(固)![]() pC(气)达到甲衡后.压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是
pC(气)达到甲衡后.压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是
A.(m+n)必定小于p B.(m+n)必定大于p
C.m必定小于p D.m必定大于p
18、下列分子中所有原子都满足最外层为8电子结构的是
A.BF3 B.H2O C.SiCl4 D.PCl5
19、相同体积的pH =3的强酸溶液和弱酸溶液分别跟足量的镁完全反应,下列说法正确的是
A.弱酸溶液产生较多的氢气 B.强酸溶液产生较多的氢气
C.两者产生等量的氢气 D.无法比较两者产生氢气的量
20、在pH=1的溶液中,可以大量共存的离子是
A.K+、Na+、SO42—、S2O32— B.NH4+、Mg2+、SO42—、Cl—
C.Na+、K+、HCO3—、Cl— D.K+、Na+、AlO2—、NO3—
第Ⅱ卷(非选择题,共60分)
二、填空题(22分)
21、(4分)已知N≡N、N—H、H—H的键能分别为946KJ·mol-1、390.8KJ·mol-1、436.0KJ·mol-1。试根据盖斯定律,写出合成氨反应的热化学方程式。
22、(8分)针对以下A~D四个涉及H2O的反应(未配平),填写空白:
A.Na202+HCI—H202+NaCl B.Ag2O+H202---Ag+O2↑+ H2O
C.H202---H20+02↑ D.H202+Cr2(S04)3+KOH----K2CrO4+K2S04+H4O
(1)H2O2仅体现氧化性的反应是(填代号) 。该反应配平的化学方程式为 。
(2)H202既能体现氧化性又能体现还原性的反应是(填代号)
(3)H202体现弱酸性的反应是(填代号) ,
23.(10分)下表是元素周期表的一部分
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | |||
(1)表中元素 ⑩ 的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)
(2)某元素原子的最外层电子数是次外层电子数的2倍多1,则该元素的元素符号是 ,其单质的电子式为
(3)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质,又如表中与元素⑦的性质相似的不同族元素是 (填元素符号) 。
三、简答推断题(28分)
24、I(实验班做---普通班不做)(12分)
有X、Y、W为常见的四种单质,常温下X是固体,Y是液体,Z是无色气体,W为黄绿色气体。其反应关系如下,其中B的溶液显强酸性。
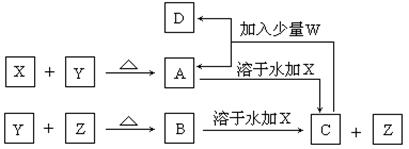
(1)根据反应推断X、Y、Z的化学式:
X___________________,Y_______________,Z_________________
(2)指出X的元素在元素周期表中的位置:_________________________
(3)写出A溶于水后加入X的离子方程式:
_______________________________________________________________
(4)写出C与过量W反应的离子方程式:
_______________________________________________________________
24、II(普通班做—实验班不做)(12分)
在一定条件下,下列物质间可发生如图所示的转化:
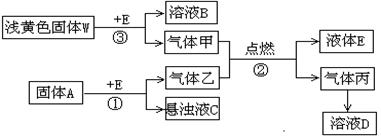
请填写下列空白:
(1)若固体A是塑料工业的重要基础原料,反应①的化学方程式为:
________________________________________________________。
将反应②产生的丙通入反应①得到的C中恰好完全反应,其离子反应方程式为:
________________________________________________________。
(2)若固体A是一种由第三周期元素组成的,不能在水溶液中存在的盐,A的化学式为________________,该情况下,若反应①生成的乙与反应③生成的甲恰好能完全发生反应②,则参加反应的W与A的物质的量之比为________________________。
25、I(实验班做---普通班不做)(10分)
在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。据此回答:
①锂在空气中燃烧,除生成 外,也生成微量的 。
②铍的最高价氧化物对应的水化物的化学式是 ,属两性化合物,证明这一结论的有关离子方程式为 \
③若已知反应Be2C + 4H2O ====2Be(OH)2 +CH4↑,则Al4C3遇强碱溶液反应的离子方程式为
④科学家证实,BeCl2属共价化合物,设计一个简单实验证明,其方法是
25、II(普通班做—实验班不做)(10分)
X、Y、Z三种元素位于周期表前20号元素之中。已知①XY2加水生成Y2Z2和化合物D;②X的氧化物加水也生成D;③Y的氧化物有两种。请填空:
(1)X、Y、Z的元素符号为X ,Y ,Z 。
(2)反应①的化学方程式为 。
(3)反应②的化学方程式为 。
26、(6分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
⑴已知:H2的燃烧热为285.8KJ ·mol-1,试写出H2的完全燃烧的热化学方程式:
。
⑵某学生查阅大量资料,提出下列“22世纪用水制取氢气的研究方向”:
①研究在水不发生化学反应的情况下制取氢气,同时释放能量
②设法将太阳光聚焦,产生高温,使水分解产生氢气
③寻找高效催化剂,大力提高水在一定条件下分解产生氢气的转化率
④寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
请你从上述研究方向中选择正确的是
四、计算题(10分)
27、(4分)
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:
A(g)+2B(g)![]() 3C(g) 已知加入1molA和3molB且达到平衡后,生成了a mol C。(1)达到平衡时,C在反应混合气中的体积分数是
(用含字线a的代数式表示)。(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为
mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比
(选填“增大”“减小”或“不变”)。
3C(g) 已知加入1molA和3molB且达到平衡后,生成了a mol C。(1)达到平衡时,C在反应混合气中的体积分数是
(用含字线a的代数式表示)。(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为
mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比
(选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入C
mol。(不要求写计算过程)
28、(6分)
氢氧化钡是一种使用广泛的化学试剂。某课外小组通过下列实验测定某试样中Ba(OH)2·nH2O的含量。
(1)称取3.50g试样溶于蒸馏水配成100mL溶液,从中取出10.0mL溶液于锥形瓶中,加2滴指示剂,用0.100mol/LHCl标准溶液滴定至终点,共消耗标准液20.0mL(杂质不与酸反应),求试样中氢氧化钡的物质的量。
(2)另取5.25g试样加热至失去全部结晶水(杂质不分解),称得质量为3.09g,求Ba(OH)2·nH2O中的n值。
(3)试样中Ba(OH)2·nH2O的质量分数为 。
附加题(10分)(实验班必做)
有1、2、3、4号4瓶未知溶液,它们是NaCl(0.1mol/L)、HCl(0.1mol/L)、NaOH(0.1mol/L)和酚酞(0.1%)。某同学不用其他试剂,就把它们一一鉴别开来了,其实验步骤如下:
①各取溶液少许两两混合,据此分成两组。
②取一组混合液,不断滴入另一组的一种未知溶液,据此可鉴别出1号和2号。
③再取已鉴别出的1号溶液2mL,滴入3滴3号未知液,再加入4号未知溶液4mL,在这个过程中无明显实验现象。综合以上实验,
可以确定1号是 ,2号是 ,3号是 ,4号是 。
华维学校2006届高三第一次月考试题
化学答题卡
一、 请把选择题的答案务必填在下面的空格里(每题3分,共60分)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 |
二、填空题(22分)
21.(4分)
__ ___
22.(8分)
(1) _______________ \_____________________________________________________________
(2) ______ __\(3)
23.(10分)
(1) \ (2) \ (3)
三、简答推断题(28分)
24、(12分) I (实验班做---普通班不做)
(1) X________ ______ Y________ _________ Z__________ ______
(2)___________ ___ ____(3)_________ _________ 、
(4)__________________________________________________________________________________、
24.(12分)II (普通班做—实验班不做)
(1)______________________________________________________________
(2)_______ ___________
(3)____________________\
25.(10分)I(实验班做---普通班不做)
(1)__________ ____、______ ________、(2)__________ ____、
_____________________ ___\ ______________ ________、
(3)____________________________________________________________、
(4)________________________________________________________________.
25.(10分)II (普通班做—实验班不做)
(1) X Y Z
(2)
(3)
26.(6分)
(1) (4分)
(2)(2分)
四、计算题(10分)
27(4分)
(1) (2) \ (3)
28(6分)
解:(1)
(2)
(3)
附加题(10分)
1号是 ,2号是 ,3号是 ,4号是 。