专题八 分子结构与晶体结构
★双基知识
1. 几个基概念
化学键:相邻的两个或多个原子间强烈的相互作用
共价键:原子间通过共用电子对所形成的相互作用
离子键:阴、阳离子通过静电作用所形成的化学键
极性键:由不同元素的原子所形成的共价键
非极性键:由相同元素的原子所形成的共价键
金属键:金属阳离子与自由电子之间较强烈的作用叫金属键。
氢键:
范德华力(分子间作用力)
极性分子 非极性分子
离子晶体 分子晶体
原子晶体 金属晶体
2.常见几种晶体的结构分析(点、线、面、体)
(1)氯化钠晶体 (2)氯化铯晶体
(3)二氧化碳晶体 (4)白磷分子的结构
(5)Cn的结构 (6)金刚石晶体
(7)二氧化硅晶体 (8) 石墨晶体
★巧思巧解
1.离子键、共价键、金属键的比较
| 离子键 | 共价键 | 金属键 | ||
| 极性共价键 | 非极性共健 | |||
| 成键元素 | 活泼的金属元素 活泼的非金属元素 | 一般是不同的非金属元素之间 | 一般是同种非金属元素之间 | 同种金属元素 |
| 成健粒子 | 阴、阳离子 | 原子 | 原子 | 金属阳离子和自由电子 |
| 粒子间相互作用 | 静电作用 | 共用电子对 | 共用电子对 | 静电作用 |
| 电子式举例 | ||||
2.四种晶体的比较
| 晶体类型 | 离子晶体 | 原子晶体 | 分子晶体 | 金属晶体 |
| 存在粒子 | ||||
| 粒子间作用 | ||||
| 熔、沸点 | ||||
| 硬度 | ||||
| 溶解性 | ||||
| 导电性 | ||||
| 实例 |
3.晶体熔、沸点比较
(1)异类晶体:原子晶体(离子晶体)分别大于分子晶体
一般地,原子晶体>离子晶体>分子晶体
(2)同种类型晶体:构成晶体质点间的作用力大,则熔、沸点高,反之则小。
①离子晶体:离子所带的电荷数越高,离子半径越小,离子键越强,则熔、沸点越高。
②分子晶体:对于组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越大,则熔、沸点越高。
在同分异构体中,一般地,支链越多,熔、沸点越低。
③原子晶体:原子半径越小,键长越短、键能越大,则熔、沸点越高
④金属晶体:金属阳离子半径越小,离子所带的电荷越多,则金属键越强,金属熔、沸点越高
★例题精析
[例1]:下列性质中,可以证明某化合物内一定存在离子键的是:( )
A.可以溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
[例2]:下列化合物中阴离子半径和阳离子半径之比最大的是:
A.LiI B. NaBr C. KCl D. CsF
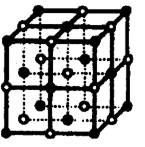 [例3]:食盐晶体如右下图所示。在晶体中●表示Na+,○表示Cl-,已知食盐的密度为ρg/cm3,NaCl的摩尔质量为M g/mol,阿佛加得罗常数为N,则在食盐晶体是Na+离子和Cl-离子的间距大约是:
[例3]:食盐晶体如右下图所示。在晶体中●表示Na+,○表示Cl-,已知食盐的密度为ρg/cm3,NaCl的摩尔质量为M g/mol,阿佛加得罗常数为N,则在食盐晶体是Na+离子和Cl-离子的间距大约是:
A.![]() B.
B. ![]()
C. ![]() D.
D.
![]()
[例4]:根据石墨晶体结构示意图及提供的数据计算(保留三位有效数值)。有关公式、数据见框图。⑴12 g石墨中,正六边形的数目有多少?
⑵求石墨密度。
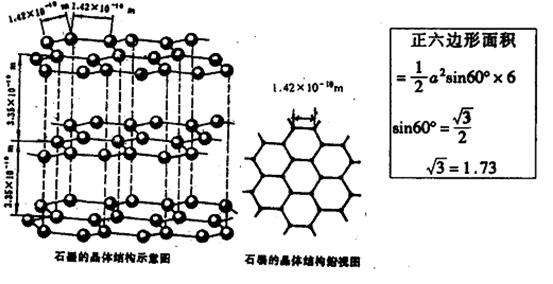 ⑶求12克石墨的体积。
⑶求12克石墨的体积。
例1.D 例2 A
例3 分析:品胞中有4个NaCl ,ρ=![]() =
= ![]() 选B
选B
例4、(1)每个六边形平均含碳6×1/3=2,正六边形个数为![]() ×6.02×1023÷2=3.01×1023 (个)
×6.02×1023÷2=3.01×1023 (个)
(2)每个六棱柱平均含碳原子 6×2×1/6 = 2(个)
ρ=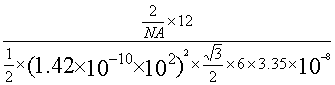 =2.28(g/cm3)
=2.28(g/cm3)
(3)12g石墨的体积为12÷2.28=5.26 (cm3)