高考第一轮复习元素周期表、周期律
一、单项选择题:
1、法国里昂的科学家最近发现一种只由四个中子组成的微粒,这种微粒称为“四中子”,也有人称之为“零号元素”。它与天体中的中子星构成类似。有关:“四中子”微粒的说法正确的
A.该微粒不显电性 B.该微粒的质量数为2
C.在元素周期表中与氢元素占同一位置 D.它与普通中子互称为同位素
2、元素X、Y、Z的原子序数都小于18,X的阳离子,Y的阳离子和Z的阴离子都具有相同的电子层结构,Y的阳离子半径小于X的阳离子半径,则元素X、Y、Z的原子序数由小到大的顺序依次是( )
A.Z、Y、X B.Y、Z、X C.Y、X、Z D.Z、X、Y
3、下列两核间距最小的离子化合物是( )
A.KCl B. NaF C. HF D. CaS
4、下列排列顺序错误的是
A.非金属性 As>S>Cl>F B.金属性 Rb>K>Mg>Al
C.稳定性 AsH3<PH3<H2S<HF D.半径 Na>P>O>F
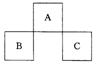 5、A、B、C均为短周期元素,它们在周期表中的位置如左图所示。
5、A、B、C均为短周期元素,它们在周期表中的位置如左图所示。
已知:B、C两元素原子最外层电子数之和等于A元素原子最外层电子数的2倍;B、C两元素的核电荷数之和是A元素原子序数的4倍。则A、B、C分别是
A.C、Al、P B.N、Si、S C.O、P、Cl D.F、S、Ar
6、两种短周期元素X和Y可组成化合物![]() ,在Y的原子序数为m时,X的原子序数为:①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6.其中正确的组合是
,在Y的原子序数为m时,X的原子序数为:①m-4 ②m+4 ③m+8 ④m-2 ⑤m+6.其中正确的组合是
A.①②④ B.①②③④⑤ C.①②③⑤ D.①②⑤
7、X、Y是元素周期表ⅦA族中的两种元素。下列叙述中能说明X的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
8、2003年,IUPAC(国际纯粹与应用化学联合会)推荐原子序数为110的元素的符号为Ds,以纪念该元素的发现地(Darmstadt,德国)。下列关于Ds的说法不正确的是( )
A.Ds原子的电子层数为7 B.Ds是超铀元素
C.Ds原子的质量数为110 D.Ds为金属元素
9、A、B、C、D四种非金属元素,A、B在反应中各结合1个电子形成稳定结构,放出能量B<A,氢化物稳定性HD>HA,原子序数C<B,其稳定结构的核外电子数相等,则四种元素非金属性由强到弱的顺序正确的是
A.A、B、C、D B.B、A、C、D C.D、A、B、C D.B、A、D、C
10、锗酸铋(简称BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中Ge元素处于最高价态,铋元素的价态与它跟氯形成某些共价化合物所呈的价态相同,且此氯化物中铋具有8电子稳定结构,可表示为![]() .则式中x等于 ( )
.则式中x等于 ( )
A.2z-4y B.![]() C.
C.![]() D.
D.![]()
二、填空题:
11、甲、乙、丙为短周期内的三种元素。乙、甲依次位于周期表中同周期的相邻主族,乙元素的族序数为丙元素的2倍。甲、乙、丙原子的价电子数之和为11,电子层数之和为7。试回答:(1)三元素的名称是:甲___________,乙___________,丙_________。
(2)丙元素单质与乙元素最高氧化物发生反应的化学方程式是:______________。
12、短周期元素A、B、C、D中,0.5mol A元素的离子得到6.02×1023个电子被还原为中性原子,0.4g A的氧化物恰好与100ml 0.2mol/L的盐酸完全反应,A原子核内质子数目与中子数目相等,B元素原子核外M层电子数目比K层多1个,C―比A元素的离子多1个电子层,D元素的原子核外L层比K层多2个电子。
(1)A、B、C、D四种元素的名称分别是 、 、 、 。
(2)画出C―和D原子的结构示意图
(3)向B、C两种元素形成的化合物的水溶液里逐滴滴入苛性钠溶液,现象为________________,写出有关离子方程式_______________________;__________________。
13、已知X、Y、Z、W四钟元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为 。
(2)由X、Y、Z所形成的离子化合物是 ,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是 。
14、A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B元素原子最外层电子数比次外层多2;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;D和E的原子序数和为30;在元素周期表中,C是E的不同周期邻族元素。
五种元素两两形成的化合物有甲、乙、两、丁四种,分子中原子个数比如下表:
| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元 素原子个比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
(1)写出元素符号:B E
(2)A元素某原子核内中子数比质子数多1,则该核素的核组成符号为 。
物质丁的分子为 分子(填“极性”或“非极性”)。
(3)向甲的水溶液中加入MnO2,氧化产物是 。
(4)已知有机物乙的分子为平面结构,碳氢键间的夹角约为120°,实验室制取乙的化学方程式为 。
(5)丙的水溶液呈酸性,与饱和NaHCO3溶液反应会产生大量气体和难溶物,有关离子方程式为 。
15、
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可反氢元素放在VIIA族,那么根据其最高正价与最低负价的绝对值相等,又可反氢元素放在周期表中的 族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是 (填名称),
写出可以验证该结论的一个化学反应方程式
参考答案
一、单项选择题:
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| A | D | B | A | C | B | C | C | C | B |
二、填空题:
11、(1)氮、碳、镁
(2)2Mg+CO2=2MgO+C
12、(1)镁、铝、氯、碳
(2) 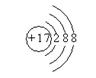 、
、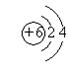 ;
;
(3)先产生白色沉淀,后沉淀溶解
Al3++3OH-=Al(OH)3↓,OH-+Al(OH)3=AlO2-+2H2O
13、(1)NH3 、Na2O、Na2O2、NaH
(2)NH4NO3
 (3)NH4++OH-→NH3+H2O
(3)NH4++OH-→NH3+H2O
14、(1)B:C E:Cl (2)![]() ;非极性 (3)O2(4)CH3CH2OH CH2=CH2↑+H2O
;非极性 (3)O2(4)CH3CH2OH CH2=CH2↑+H2O
(5)Al3++3HCO3—=Al(OH)3↓+3CO2↑
15、(1)右表中
| Na | Cl | ||||||||||||||||
(2)IVA
(3)① 右表中
② 氯
H2S + Cl2 → 2HCl + S↓