通高等学校招生全国统一考试理科综合化学能力测试3
第 Ⅰ 卷
(选择题,共126分)
本卷共21小题,每小题6分,共126分。在每小题列出的四个选项中,选出符合题目要求的一项。
7.下列说法正确的是( )
A.H与D,16O与18O互为同位素;H216O、D216O、H218O、D218O互为同素异形体;甲醇、乙二醇和丙三醇互为同系物
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.HI的相对分子质量大于HF,所以HI的沸点高于HF
D.由ⅠA族和ⅥA族元素形成的原子个数比为1∶1、电子总数为38的化合物,是含有共价键的离子型化合物
8.下列各组离子在溶液中能大量共存的是( )
A.酸性溶液Na+、K+、MnO4-、Br-
B.酸性溶液Fe3+、NH4+、SCN-、NO3-
C.碱性溶液Na+、K+、AlO2-、SO42-
D.碱性溶液Ba2+、Na+、CO32-、Cl-
9.在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
1/2N2(g)+CO2(g);ΔH=-373.2 kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度
B.加催化剂同时增大压强
C.升高温度同时充入N2
D.降低温度同时增大压强
10.下列除杂质的方法不可行的是( )
A.用过量氨水除去Al3+溶液中的少量Fe3+
B.将混合气体通过灼热的铜网除去N2中少量O2
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.用盐酸除去AgCl中少量的Ag2CO3
11.下列叙述正确的是( )
A.反应Na2O2+2HCl=2NaCl+H2O2为氧化还原反应
B.反应HOCH2-![]() -CH(OH)CH2COOH+HBr
-CH(OH)CH2COOH+HBr![]() BrCH2-
BrCH2-![]() -CH=CHCOOH+2H2O 仅涉及消去反应类型
-CH=CHCOOH+2H2O 仅涉及消去反应类型
C.10mL 0.02 mol/L AgNO3溶液与10mL 0.02 mol/L HCl溶液混合后,溶液的pH=2(设溶液总体积不变)
D.10mL 0.04 mol/L HCl溶液与10mL 0.02 mol/L Na2CO3溶液混合后,溶液的pH=7(设溶液总体积不变)
12.金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B.电解过程中,阳极质量的减少与阴极质量的增加相等
C.电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D.电解后,电解槽底部的阳极泥中只有Cu和Pt
13.下列实验操作或事故处理中,正确的做法是( )
A.银镜反应实验后附有银的试管,可用稀H2SO4清洗
B.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
C.不慎将浓硫酸沾在皮肤上,立即用NaOH溶液冲洗
D.在250mL 烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液
第 Ⅱ 卷
(非选择题,共174分)
本卷共10小题,共174分。
26.(14分)A和B均为钠盐的水溶液,A呈中性,B呈碱性并具有氧化性。下述为相关实验步骤和实验现象:
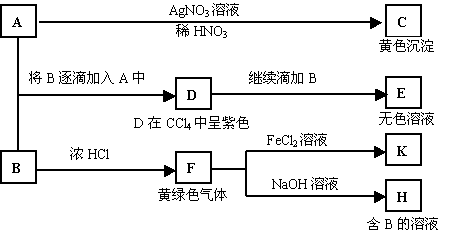
请回答:
(1)写出A、B和C的化学式:A ,B ,C 。
(2)依次写出A→D和D→E(E中含有某+5价元素的含氧酸根离子)的离子方程式: , 。
(3)写出将SO2气体通入K溶液中发生反应的离子方程式: 。
(4)写出由F→H的化学方程式: 。
27.(19分)
Ⅰ.某天然油脂A的分子式为C57H106O6。1mol 该油脂水解可得到1mol甘油、1mol不饱和脂肪酸B和2mol直连饱和脂肪酸C。经测定B的相对分子质量为280,原子个数比为C∶H∶O=9∶16∶1。
(1)写出B的分子式: 。
(2)写出C的结构简式: ;C的名称是 。
(3)写出含5个碳原子的C的同系物的同分异构体的结构简式: 。
Ⅱ.RCH=CHR′与碱性KMnO4溶液共热后酸化,发生双键断裂生成羧酸:
RCH=CHR’![]() RCOOH+R’COOH,常利用该反应的产物反推含碳碳双键化合物的结构。在催化剂存在下,1mol不饱和脂肪酸B和1molH2反应后经处理得到D和E的混合物,D和E互为同分异构体。当D和E的混合物与碱性KMnO4溶液共热酸化后,得到如下四种产物:
RCOOH+R’COOH,常利用该反应的产物反推含碳碳双键化合物的结构。在催化剂存在下,1mol不饱和脂肪酸B和1molH2反应后经处理得到D和E的混合物,D和E互为同分异构体。当D和E的混合物与碱性KMnO4溶液共热酸化后,得到如下四种产物:
HCOOC-(CH2)10-COOH,CH3-(CH2)7-COOH
HCOOC-(CH2)7-COOH,CH3-(CH2)4-COOH
(4)写出D和E的结构简式: 。
(5)写出B的结构简式: 。
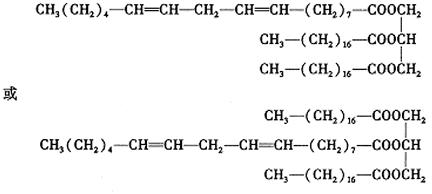
(6)写出天然油脂A的一种可能结构简式: 。
28.(19分)根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30~35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
|
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 39.8 |
| NH4HCO3 | 11.9 | 15.8 | 21.0 | 27.0 | -① | - | - | - |
| NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 | - |
| NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.3 | 77.3 |
①>35℃ NH4HCO3会有分解
请回答:
(1)反应温度控制在30~35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是
。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)= 。
29.(14分)磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为Y kJ/mol,则1mol P与O2反应生成固态P2O3的反应热ΔH= 。
(3)写出1mol P与O2反应生成固态P2O3的热化学方程式: 。
答 案
7.D
提示:
HF分子间存在氢键而使其沸点在HX中最高。
8.C
9.B
提示:
D中由于降低了温度,所以反应速率减小。
10.A
11.C
12.D
提示:
根据电解精炼铜原理知,电解制备高纯度Ni时要用NiSO4做电解质溶液,且电解前后Ni2+浓度基本不变。所以,溶液中还有大量的Ni2+ 。
13.B
提示:
硫酸铜晶体里结晶水含量的测定实验中,①要称量坩埚质量,②要称量坩埚与样品的质量和,③要称量失水并干燥后的质量至少2次,且这两次称量得到的质量差不超过0.1克。
26.(1)NaI NaClO AgI
(2)2I-+ClO-+H2O=I2+Cl-+OH- I2+5ClO—+2OH—=2IO3-+5Cl-+H2O
(3)2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
(4)Cl2+2NaOH=NaClO+NaCl+H2O
27.(1)C18H32O2
提示:
(C9H16O)n=280,所以n=2
(2)CH3—(CH2)16—COOH 硬脂酸(或十八烷酸、十八酸)
提示:
M(C)=[M(C57H106O6)+3M(H2O)-M(B)-M(甘油)] /2=[886+54-280-92] /2=284
则CnH2n+1COOH=284,所以n=17
(3)CH3CH2CH2CH2COOH , CH3CH2 ![]() COOH
, CH3
COOH
, CH3 ![]() CH2COOH
, (CH3)3CCOOH
CH2COOH
, (CH3)3CCOOH
提示:
C4H9COOH的同分异构体,实质为-C4H9的同分异构体,有4个。
(4)CH3(CH2)7-CH=CH-(CH2)7-COOH , CH3(CH2)4-CH=CH-(CH2)10-COOH
提示:
B是不饱和脂肪酸,与H2加成后生成的D、E仍为脂肪酸;由于D、E互为同分异构体,所以二者分子中C原子数相同,如下交差连接并把2个-COOH变为-CH=CH-即可。
![]()
注意:
不要认为被KMnO4氧化后生成的分子内的2个-COOH都是C=C形成的。
(5)CH3(CH2)4-CH=CH-CH2-CH=CH-(CH2)7-COOH
提示:
根据D、E的结构差别,在D或E中变一个C-C为C=C后,在两个不同位置的C=C分别加1摩H2会得到E或D,只有将-(CH2)10-变为-CH=CH-(CH2)7-才行。
(6)
提示:
此题虽然分Ⅰ、Ⅱ两部分给出信息并分别设问,但,又不能把两部分分割开来,审题时要前后对照。
28.(1)NH4HCO3分解;反应速率降低;水浴加热。
(2)使反应充分进行;NaHCO3的溶解度最小;NaCl,NH4Cl,NH4HCO3 。
(3)NaHCO3 , NaCl , NH4Cl , NH4HCO3 ; HCl 。
提示:
根据题示要求“使NaCl溶液循环使用,同时可回收NH4Cl”,所以需要引入Cl同时除去HCO3-,故加HCl。
(4)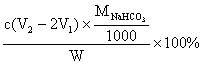
提示:
Na2CO3 + HCl = NaCl + NaHCO3
106g 1 mol 84g
m(Na2CO3) cV1×10-3 mol m(NaHCO3)
m(Na2CO3)=0.106cV1 g m(NaHCO3)=0.084 cV1 g
NaHCO3 + HCl = NaCl+H2O+CO2↑
84g 1 mol
0.084 cV1 g + m c(V2-V1)×10-3
mol
m=0.084 c(V2-2V1)g
![]()
29.(1)P2O3 P2O5 2.75 3.55
提示:
参加反应的P、O原子个数比为![]() ,所以生成物为P2O3和P2O5的混合物,且生成物中P2O3和P2O5的物质的量之比为1∶1。反应方程式如下:4P+4O2=P2O3+P2O5
,所以生成物为P2O3和P2O5的混合物,且生成物中P2O3和P2O5的物质的量之比为1∶1。反应方程式如下:4P+4O2=P2O3+P2O5
(2)-(20X-Y)kJ/mol
提示:
燃烧热的概念是1 mol可燃物燃烧生成稳定生成物时的热效应。此题对应生成P2O5时的热效应为磷的燃烧热。由
P+5/4O2=1/2P2O5 ;△H=-Y kJ/mol
71g Y kJ
3.55g 0.05 Y kJ
P+4/3O2=1/2P2O3 ;△H
55g △H
2.75g -(X-0. 05 Y)kJ
所以△H=-(20X-Y)kJ
(3)![]()