普通高中毕业班化学综合测试(一)
化 学
2006.3
本试卷分选择题和非选择题两部分,共10页,满分150分。考试用时120分钟。
注意事项:
1.答卷前,考生务必用黑色字迹钢笔和签字笔将自己的姓名和考生号填写在答题卡上,用2B铅笔将试卷类型填涂在答题卡上。
2. 选择题每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑;如需改动,用橡皮擦擦干净后,再选涂其他答案标号,不能答在试卷上。
3. 非选择题必须用黑色字迹钢笔和签字笔作答,答案必须写在答题卡各题目指定区域内的相应位置上;如需改动,先划掉原来的答案,然后写上新的答案;不准使用铅笔和涂改液。不按以上要求作答的答案无效。
4.考生必须保持答题卡的整洁,考试结束,考生将本试卷和答题卡一并交回。
第一部分(选择题 共67分)
一、选择题(本题包括9小题,每小题3分,共27分,每小题只有一个选项符合题意)
1.据报道,全球每年因发生金属腐蚀而造成的直接经济损失达数千亿美元。下列各电极反应式中,能表示铁的电化学腐蚀的是
①Fe-2e-=Fe2+ ②2H+ + 2e- = H2↑ ③ Fe + 2Fe3+ = 3Fe2+
④2H2O + O2 + 4e- = 4OH- ⑤4OH- - 4e- = 2H2O + O2↑
A.①②⑤ B.②③④ C.①②④ D.①③⑤
2.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的相互作用依次是
A.氢键;分子间作用力;非极性键 B.氢键;氢键;极性键
C.氢键;极性键;分子间作用力 D.分子间作用力;氢键;非极性键
3.设NA为阿伏加德罗常数,下列说法正确的是
A.常温常压下,8g氦气所含有的中子数目为4NA
B.标准状况下,11.2L臭氧中含有的氧原子数 目为3NA
C.0.1mol·L-1CH3COONa溶液中阴离子总数约为0.2N A
D.用NaOH溶液吸收氯气22.4L,反应中转移的电子数目为NA
4.要提纯下列物质(括号内物质为杂质),实验操作最合理的是
A.CO2(SO2):通入盛有品红溶液的洗气瓶
B.已烷(已烯):加入足量的溴水,充分振荡,静置分层后分离
C.硫酸铁溶液(硫酸亚铁):通入足量的氯气,充分反应后加热,使多余的氯气逸出。
D.Mg(OH)2[Ca(OH)2]:放入水中调成浆状后,加入足量MgCl2溶液,充分搅拌,过滤,沉淀用蒸馏水洗涤
5.氯酸钾跟浓盐酸反应生成氯气,化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O若反应使用的是K37ClO3和H35Cl,则所得氯气的摩尔质量(g·mol-1)约为:
A.70.7 B.71.0 C.72.0 D.73.3
6.下列为某同学根据中学化学教材中的数据所做的判断,其中错误的是
A.根据溶解度数据,判断长时间煮沸Mg(HCO3)2溶液所得的沉淀是MgCO3还是Mg(OH)2
B.根据沸点数据,判断能否用分馏的方法分离一些液体混合物
C.根据反应热数据,判断不同反应的反应速率的大小
D.根据相对分子质量数据,判断组成和结构相似的物质的熔点和沸点的高低
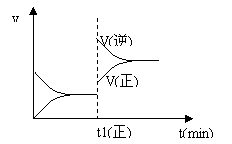 7.下图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
7.下图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
A.2SO2(g)+O2(g) ⇌ 2SO3(g) ; ΔH<0
B.4NH3(g)+5O2(g) ⇌ 4NO(g)+6H2O(g) ; ΔH<0
C.H2(g)+I2(g) ⇌ 2HI(g) ; ΔH>0
D.C(s)+H2O(g) ⇌ CO(g)+H2(g); ΔH>0
8.下列实验操作正确的是
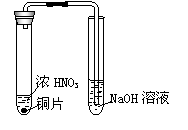 A.清洗做过银镜反应的试管前,先用浓氨水溶解管壁上的银镜
A.清洗做过银镜反应的试管前,先用浓氨水溶解管壁上的银镜
B.清洗刚制取过氨气的反应管,先用盐酸中和管内的残留固体
C.清洗刚制取过NO2的装置(右图)前,先使右管中的NaOH溶液
倒吸至左管中
D.观察铜片与浓硫酸反应后溶液的颜色,要待反应混合物冷却
至室温后,再加水稀释
9.肼(N2H4)是火箭发动机的一种燃料,反应时N2H4为氧化剂,生成N2和H2O(g)。已知:
N2(g)+2O2(g)=N2O4(g) ; ΔH=+8.7kJ·mol-1 N2H4(g)+O2(g)= N2(g)+2H2O(g);ΔH=-534.0kJ·mol-1下列表示N2H4跟N2O4反应的热化学方程式,正确的是:
A.2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g);ΔH=-542.7kJ·mol-1
B.2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g);ΔH=-1059.3kJ·mol-1
C.N2H4(g)+1/2N2O4(g) =3/2N2(g)+2H2O(g);ΔH=-1076.7kJ·mol-1
D.2N2H4(g)+N2O4(g) =3N2(g)+4H2O(g);ΔH=-1076.7kJ·mol-1
二、选择题(本题包括10小题,每小题4分,共40分,每小题有一个或两个选项符合题意,若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且正确的给4分,但只要选错一个,该小题就为0分。)
10.油脂是主要的食物之一,也是一种重要的化工原料.下列说法中正确的是
A.油脂在酸性条件下水解生成甘油和肥皂
B.植物油氢化后可用作人造奶油
C.植物油不能使溴的四氯化碳溶液褪色
D.判断油脂皂化反应是否否本完成的方法是静置反应混合物观察其是否分层
11.元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M层电子数为(a-b),L层电子数为(a+b),则A、B两元素所开成的化合物的性质可能有
A.能与水反应 B.能与硫酸反应 C.能与氢氧化钠反应 D.能与碳酸钠反应
12.下列反应的离子方程式书写正确的是
A.小苏打溶液和甲酸钠溶液混合 HCO3-+ HCOOH = HCOO- +CO2 ↑+ H2O
B.铝片放入氢氧化钠溶液 Al + 2OH- = AlO2- + H2↑
C.次氯酸钙溶液中通入过量二氧化碳 Ca2+ +2ClO- +CO2 +H2O = CaCO3 ↓+ 2HClO
D.氨水中通入少量二氧化硫 2NH3•H2O + SO2 = 2NH4+ +SO32- +H2O
![]() 13.L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
13.L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下:
|
|
A.能与FeCl3溶液发生显色反应 B.能与溴水发生加成反应
C.L-多巴在空气中容易变质 D.1molL-多巴最多可以和3molNaOH反应
14.金属锂用途广泛,尤其在核工业上有着重要应用,下列关于金属锂的叙述中,正确的是
A.灼烧氯化锂时,火焰有特殊的颜色 B.氢氧化锂是弱碱
C.锂单质可以跟NaCl溶液发生置换反应 D.锂、钠、钾三种单质中,锂的熔点最低
15.高温高压和使用催化剂的条件下,在密闭容器中发生如下反应:CO(g)+ 2H2(g)⇌ CH3OH(g)
若开始时只充入a molCH3OH气体,达至平衡时,混合物的压强比起始时增大了70%;若开始时充入a molCO和2a molH2的混合气体,达至平衡时H2的转化率为
A.30% B.35% C.65% D.70%
16.将粗铜、精铜和硫酸铜溶液组成电解池,利用电解的方法可以将粗铜提纯。下列有关粗铜精炼的叙述中,正确的是
A.粗铜连接电源的正极,发生的反应为Cu-2e- =Cu2+
B.阳极发生还原反应
C.电解过程中,阳极质量的减少与阴极质量的增加相等
D.由于阳极上铜溶解的速率与阴极上铜沉积的速率相等,所以溶液中硫酸铜的浓度基本保持不变
17.下列混合溶液中,各离子浓度的大小顺序正确的是
A.浓度均为0.1mol·L-1的氨水与盐酸等体积混合 c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.浓度均为0.1mol·L-1的氯化铵溶液与氢氧化钠溶液等体积混合 c(Na+)=c(Cl-)>c(OH-)>c(H+)
C.浓度均为0.1mol·L-1的氯化铵溶液与氢氧化钠溶液等体积混合 c(Na+)=c(Cl-)>c(OH-)>c(H+) D.10mL0.5mol·L-1的醋酸钠溶液与6mL1mol·L-1的盐酸混合c(Cl-)>c(Na+)>c(OH-)>c(H+)
18.几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | L | M | X | R | T |
| 原子半径(nm) | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
下列叙述正确的是
A.R的氧化物对应的水化物可能具有两性 B.X单质可在氧气中燃烧生成XO3
C.离子半径大小:r(M3+)<r(T2-) D.L2+和X2-的核外电子数相等
19.背景材料:①去年12月,我省北江因某企业起标排放含镉污水,水体受到严重污染;②镉(元素符号Cd)和锌是同族元素,在自然界中镉常与锌、铅共生;③镉化合物中的硫化镉属低毒类;④专家表示“不能治一个污染又造成另一个污染”,在用药选择上,放弃了投放硫化钠的方案,使用了对人没有危害的无机高分子絮凝剂聚合硫酸铁。根据以上材料,下列相应说法正确的是
A.镉是ⅡA族的元素
B.污染物镉离子的符号是Cd3+
C.硫化镉和氢氧化镉都几乎不溶于水
D.治污的两种方案都使污染物与药剂发生氧化还原反应而除去
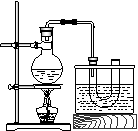 第二部分 非选择题(共83分)
第二部分 非选择题(共83分)
三、填空题(本题包括2小题,共24分)
20.(16分)研究性学习小组进行溴乙烷的制备及性质探究实验。
探究一:该小组制备溴乙烷的主要步骤如下:
①各装置图所示的U开管和大烧杯中加入冷水;
②在小烧杯中按一定比例配制乙醇、水、浓硫酸混合液;
③各装置图所示的圆底烧瓶中加入一定量研细的溴化钠和少量碎瓷片;
④将冷却至室温的混合液转移到圆底烧瓶中,加热;
⑤精制溴乙烷。
回答下列问题:
⑴步骤②向乙醇和水中缓缓加入浓硫酸时,小烧杯要置于冷水中冷却,除了避免硫酸小液滴飞溅外,更重要的目的是
⑵步骤④加热片刻后,烧瓶内的混合物出现橘红色,出现这种现象的原因是(请用化学方程式表示) ,改用小火加热后,橘红颜色会逐渐消失,消失的原因是(请用化学方程式表示) 。
⑶为了更好的控制反应温度,除按图示小火加热,还可采用的加热方式是
。
⑷步骤⑤反应结束后,将U形管中混合物倒入分液斗中,静置,待液体分层后,弃去(填“上层”或“下层”) 液体。为了除去粗产吕中的杂质,可用下列试剂中的 (填序号)
A.氢氧化钠稀溶液 B.碳酸钠稀溶液
C.硝酸银溶液 D.四氯化碳
探究二:溴乙烷与NaOH乙醇溶液的反应
学习小组在进行溴乙烷与NaOH乙醇溶液的反应中,观察到有气体生成。
请你设计两种不同的方法分别检验该气体,并使用下列简易图标,在答题卡的方框中画出这两种方法的实验装置示意图(所给各种图标,使用次数不限,也可以不全不用),并写出装置中所盛试剂的名称(试剂任选)和实验现象。
 |
| 装置示意图 | 所盛试剂 | 实验现象 | |
| 1 | |||
| 2 |
21.(8分)为了证明(NH4)2Fe(SO4)2·6H2O(硫酸亚铁铵晶体)的成分中含有Fe2+,按如下步骤进行操作:
第一步:对试样进行观察,说明试样中可能有Fe2+存在的外观特征是
第二步:取少量试样配成溶液,可以在此推断试样中可能含有Fe2+的现象是
第三步:操作的目的是 ,具体操作过程,现象及结论是
。
四、(本题包括2小题,共21分)
22.⑴-5°C时,高氙酸钠(Na4XeO6)能跟浓硫酸反应生成XeO4气体。XeO4极不稳定,固体XeO4在-40℃。C也可能发生爆炸生成氙气和氧气。请分别写出两个反应的化学方程式: ;
⑵Xe的原子序数为54,Xe核外M层和N层的电子数分别为 和 。
⑶高氙酸钠用于分析锰、铈和铬等元素,显示有突出的优越性,例如高氙酸钠在酸性溶液中能将Mn2+氧化成MnO4-,生成XeO3。高氙酸钠在水溶液中与发生了如下反应:Na4Xe06+H2O=NaOH+Na3HXeO6,请写出高氙酸钠溶液和硫酸锰的硫酸水溶液反应的离子方程式: ,若有1molNa4XeO6参加反应,转移电子 mol.
23.
25℃时,将体积Va,PH=a的某一元强碱与体积为Vb。PH=6的某二元强酸混合。
⑴若所得混合液的PH=11,且a=13,b=2,则Va:Vb=
⑵若所得溶液的PH=7,且已知Va〉Vb,b=0.5a,b值可否等于4(填“可”或“否”) ,其理由是 。
⑶为了更好表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG的定义为AG=lg(c(H+)/c(OH-))。25。C时,若溶液呈中性,则AG= ,溶液的PH与AG的换算公式为AG= (要化简)
五、(本题共2小题,共18分)
![]() 24.(9分)芳香族化合物A是某些植物挥发油的主要成分,其苯环上只有一个取代基,A的相对分子质量不超过150,完全燃烧只生成CO2和H2O,且分子中氧原子的质量分数为12.12%。Ae如下转化关系:
24.(9分)芳香族化合物A是某些植物挥发油的主要成分,其苯环上只有一个取代基,A的相对分子质量不超过150,完全燃烧只生成CO2和H2O,且分子中氧原子的质量分数为12.12%。Ae如下转化关系:
(Ⅰ)A B
(Ⅱ)B C D E
(Ⅲ)B E
根据以上信息填空:
⑴A的分子式是 A中官能团的名称是
⑵C的结构简式是
⑶写出反应⑤的化学方程式:
⑷反应③生成D的同时,是否还有可能生成别的有机物,若有,请写出其结构简式。
![]() 25.(9分)已知①苯环上新导入的取代基的位置主要与原取代剂的性质有关,把原取代基称为定位基。若定位基使新导入的取代基进入它的邻位或对位,该定位基叫作邻、对位定位基,例如烷烃基;若定位基使新导入的取代基进入它的间位,该定位基叫间位定位基,例如-NO2或-COOH
25.(9分)已知①苯环上新导入的取代基的位置主要与原取代剂的性质有关,把原取代基称为定位基。若定位基使新导入的取代基进入它的邻位或对位,该定位基叫作邻、对位定位基,例如烷烃基;若定位基使新导入的取代基进入它的间位,该定位基叫间位定位基,例如-NO2或-COOH
②卤代烃跟苯可发生如下反应:R-X + +HX
![]() (若苯环上有间位定位基时,该反应不能发生。)
(若苯环上有间位定位基时,该反应不能发生。)
③苯的同系物可发生如下反应:
请依次写出从原料苯和乙烯出发(无机试剂任选),合成间-硝基苯甲酸的各步反应的化学方程式(其中生成-COOH 的化学方程式可不写),并注明反应条件。
六、(本题共2小题,每小题10分,共20分)
26.(8分)某研究性学习小组选用一种硬铝合金(主要含铝、其次是镁、硅、铜)进行探究。向1.5g样品中加入足量盐酸,待反应完毕后,收集到气体1736ml(标准状况下)。将反应混合物过滤,向滤液中加入过量NaOH溶液,充分反应后再过滤;向滤液中通入足量CO2,滤出沉淀。将沉淀加热蒸干、灼烧,得白色固体2.55g,请计算这种硬铝合金中含镁的质量分数。
27.(12分)若不慎发生砒霜泄露,应急的措施是采用石灰中和,使被污染的河水含砷量降低到国家允许的标准范围内,以消除可能会造成的危害。
测定砷是利用下述反应:AsO33- + I2 + H2O ⇌ AsO43- + 2I- +2H+ 这反应是可逆的,控制溶液的酸碱性,右以测定不同价态(+3或+5)的砷。
今有一试样,含As2O3的As2O5及其它对测定不,以有影响的杂质。将此试样用NaOH溶液溶解后,在中性溶液中用0.02mol·L-1的I2-KI溶液滴定,用去25.00mL。滴定完毕后,使溶液呈酸性,加入过量的KI。由此析出的碘又用0.125mol·L-1的223溶液滴定,用去24.00。试计算试样中As2O3和As2O5的质量。
(已知2Na2S2O3 + I2 = Na2S4O6 + 2NaI)