普通高中会考化学试卷
可能用到的原子量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Fe-56 Cu-64
一、选择题(每小题 2分,共50分。每小题只有一个正确选项)
1.同组物质间互称同位素的一组是
A.23592U和23892U B.H2O和D2O C.金刚石和石墨 D.4019K和4020Ca
2.下列卤素氢化物中,稳定性最弱的是
A.HCl B.HF C.HBr D.HI
3.下列物质中能使品红溶液褪色,加热后溶液又恢复原来颜色的是
A.Cl2 B N2 C.SO2 D.CO2
4.下列物质,既含离子键又含共价键的是
A. KBr B. NaOH C. HCl D.N2
5.下列物质属于混合物的是
A.石油 B.冰醋酸 C.液氯 D.甘油
6.在高炉炼铁中,还原铁矿石里铁的还原剂主要是
A.CaCO3 B.C C.SiO2 D.CO
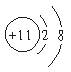
7.表示下列微粒结构的图式,不正确的是
![]()
A.乙烯的结构式: B.钠离子的结构示意图:
C.氢分子的电子式:H:H D.氯化氢分子的电子式:H+[:Cl:]-
|
8.A、B、C均为短周期元素,它们在周期表中的位置如右图所示:B、C两元素原子序数之和为A元素原子序数的4倍,则A、B、C依次是
A.C、Al、P B.N、Si.S C.O、P、Cl D.F、S、Ar
9.常温下,下列物质在空气中容易被氧化的是
A.硫粉 B.白磷 C.二氧化硅 D.氯化钠
10.表示下列反应的离子方程式正确的是
A.氢氧化钡溶液与稀硫酸反应 Ba2++2OH-+2H++SO2-=BaSO4¯+2H2O
B.稀盐酸与碳酸钙反应 CO32-+2H+=CO2+H2O
C.漠化钠溶液与氟水反应 Br-+Cl2=Br2+Cl-
D.醋酸溶液与氢氧化钠溶液反应 H++OH-=H2O
11.下列各组物质中,可发生氧化还原反应,且水既不是氧化剂,又不是还原剂的是
A.F2与 H2O B. Na与 H2O C.SO2与H2O D.NO2与H2O
12.下列含氧酸的酸酐,不能由单质在空气中燃烧直接得到的是
A.H2CO3 B.H3PO4 C.H2SO4 D.H2SO4
l3.下列物质不能通过化合反应直接得到的是
A.NaOH B.H2SO4 C.NaCl D.Al(OH)3
14.用加热的方法就可以除去下列物质中少量杂质(括号内物质为杂质)的是
A.KCl溶液(KBr) B.NaCl(NH4Cl) C.FeC12溶液(CuCl2) D.CH3CH2OH(H2O)
15.下列有关大气污染的说法不正确的是
A.大量含硫燃料的燃烧和金属矿石冶炼的废气,导致酸雨的形成
B.粉尘也是污染大气的有害物质之一
C.随着人口的增加,人体排出的二氧化碳会导致“温室效应”
D.汽车尾气和煤等燃料燃烧产生的废气中的某些成份能与血红蛋白结合
16.硝酸与下列物质作用,硝酸既表现了氧化性,又表现了酸性的是
A.Fe(OH)2 B.Al(OH)3 C.C D. CaCO3
16.下列各组离子,在强酸性溶液中能大量共存的是
A.Al3+、K+、NO3- B. Fe2+、Na+、NO3-
C.Na+、Cl一、HCO3- D.Na+、SO32一、S2-
18.将l.2mol金属钠分别与下列物质充分反应,在标准状况下生成11.2L氢气的是
A.lmol乙醇 B.lmol乙二醇 C.含lmolCH3COOH的水溶液 D、lmol丙三醇
19.某烃的结构简式为:CH2(CH3)-CH(CH3)—CH2(CH3),它的名称是
A.3-甲基戊烷 B.1,2,3-三甲基丙烷 C.2-乙基丁烷 D.3-乙基丁烷
20.某有机物的结构简式为CH2=C(CH3)-COOH,它不可能具有的性质是
A.使酸性高锰酸钾溶液褪色. B、发生加聚反应
C.发生银镜反应 D.发生还原反应
21.区别稀盐酸和氯化钠溶液应选用的方法是
A.滴加硝酸银溶液 B.滴加碳酸钠溶液
C.滴加淀粉碘化钾溶液 D.滴加酚酞试液
22.化学实验室中若发生下列事故,处理不正确的是
A.皮肤沾上浓硫酸立即用布擦试,然后用较多水冲洗,再用3%-5%的碳酸氢钠溶液冲洗。
B.酒精灯不慎碰倒,流出的酒精燃烧起来,可用水熄灭
C.苯酚沾在手上立即用酒精清洗
D.碱溶液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液
23.通常状况下,在容积相同的密封容器中,将下列气体充分混合后,容器内压强最小的是
A.100mlH2和50mlO2 B.100mlNO和50mlO2
C.100mlH2和50mlN2 D.100mLHCl和50mLNH3
24.已知NOx+NH3=催化剂=N2+H2O可治理汽车尾气及工业废气NOx,称氨的催化还原法。现有NO和NO2混合气体3L,可用同温同压下3.5LNH3恰好使它完全转化为N2。则原混合气体中NO和NO2。的体积比为
A.2:3 B.3:2 C.l:3 D.3:l
25.下列各组物质的溶液,只用组内物质相互反应就能鉴别的是
①Na2SO4 BaCl2 K2CO3 KNO3
②NaCl AgNO3 CaC12 NaNO3
③(NH3)2SO4. KOH Ba(OH)2 H2SO4
④CuSO4 BaC12 NaOH NaCI
A、①② B.③④ C.③ D.④
二、填空题(共18分)
26.配平下列氧化还原方程式并回答:
______ NH3+ _____ O2= _______ NO+ ____ H2O
如果反应后得到lmolH2O,则反应中有________mol氮原子被氧化。
27.长久放置的浓硝酸呈黄色是因为其中溶有______;工业用盐酸显黄色,是因为其中含有_______。
28.有标准状况下的四种气体:①6.72L甲烷,②3.01´1023个氯化氢分子,③13.6g硫化氢,④0.2mol氨气。这四种气体的体积最大的是(用序号回答,下同)_______,质量最大的是_______,
密度最大的是______,所含氢原子最多的是_______。
29.根据物质结构与元素周期律及周期表的知识,回答下列问题:
(1)第三周期中,最活泼的非金属元素是(填元素名称)_,其最高价氧化物的水化物的化学式是_______。
(2)某元素位于第三周期VIA族,该元素的元素符号是_______。
(3)若用M代表IA族元素,其最高价氧化物的水化物的化学式是________。
(4)某元素A与氟元素能形成离子化合物AF2。其中阴、阳离子的电子层结构相同,则A元素的元素符号是_______。
(5)钾元素与铝元素位于不同周期和不同主族,但可以通过另一种元素作参照,比较出钾 与铝的金属性强弱,这种参照元素是_______。
(6)碳和硅位于同一主族,碳的一种单质(金刚石)和硅的单质(晶体硅)是结构相似的原子晶体,但晶体硅的熔点_________(填“高于”或“低于”)金刚石,原因是晶体中Si-Si键的键能比C-C键的键能_________。
三、填空题(共21分)
|
|
![]()
![]()
![]() A
B
C
D
A
B
C
D
Ag O2
|
![]() E
F
E
F
试回答:
(1)A、F的结构简式为:
A、_____________,F__________________。
(2)写出下列转化的化学方程式,并指明有机反应类型:
B→C______________________________,反应类型。
C→D______________________________,反应类型。
31. 有A、B、C、D四瓶失去标签的无色溶液,它们分别是硝酸钡溶液、氨水、硫酸铝溶液和氢氧化钠溶液中的一种,其相互关系如下图所示:
|
|
![]()
![]()
![]() 先有沉淀后消失
先有沉淀后消失
![]() D
D
|
![]()
![]() 白色沉淀
沉 沉淀不溶解
白色沉淀
沉 沉淀不溶解
A是__________溶液;B是___________溶液;
C是__________溶液;D是___________溶液。
32.请利用下图中的仪器及试剂组装成一套系列实验装置。其实验步骤是;先制取纯净、干燥的Cl2(不收集),再试验该氯气能否使干、湿两种有色布条褪色。试回答下列问题:
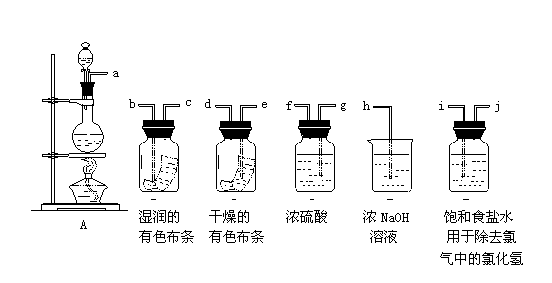
(l)按气体从左到右的流向将各装置依次连接起来(填接口标号):
a接__,__接__,__接__,__接__,__接__;
(2)分液漏斗中所盛液体是___________;
(3)烧瓶中发生反应的化学方程式是:___________________________________________.
(4)D装置的作用是________________;
E装置的作用是________________;
(5)C瓶中的现象是_________________;
B瓶中的现象是_________________;
以上实验现象说明起漂白作用的物质是(写化学式)____________。
四、计算:(共11分)
33.5.3g某烃完全燃烧后得到标准状况下8.96L的CO2气体,该烃的蒸气密度是氢气的53倍。求该烃的分子量和分子式。
34.有铁和氧化铁组成的粉末状混合物19.2g,向其中加入250ml未知浓度的稀硫酸,当固体全部溶解时,放出3.36L氢气(标准状况)。经测定,加入的硫酸实际上消耗了3/5,且反应后的溶液中不含三价铁离子,求:(l)混合物中铁和氧化铁的质量各为多少?(2)所加稀硫酸的物质的量浓度是多少?