化学高三化学第二轮复习
[课题] 无机框图推断的思路与技巧
[高考要求]
1.掌握非金属元素单质及其化合物的相互转化关系。
2.掌握金属元素单质及其化合物的相互转化关系。
3.运用元素单质及其化合物的性质进行物质的推断及检验。
[高考预测]
纵观近几年高考:重点考查了氯、硫、氮、碳(硅)、钠、铝、铁等元素及其化合物性质。预计2006年高考仍以上元素考查为重点,一些物质如氮化物、氢化物、碳化物等性质须注意。
趋势为:(1)题目小型化,定性推断渗透定量内容(如04江苏,21)
(2)元素推断与无机框图的融合,增大了题目的综合程度。
[教学说明]
无机框图推断题具有明显的学科特点,它既能检验学生对基础知识的掌握情况,又能考查学生灵活运用知识的能力,更能考查学生分析问题、进行逻辑推理的能力,对学生的综合能力要求较高,难度通常较大,是每年高考的必考题,也是难点之一。为此,在二轮复习时安排了无机推断题的专题复习,通过该专题讲练,让学生在综合测试时能从容的应付各种无机推断。
[教学方法] 讲练结合
[教学过程]
一、题型“三特点”:
“无机框图推断题”作为高考考查元素化合物知识的热点题型,它的主要特点是:①结构紧凑、文字表述少②包含信息多、综合性强,思维能力要求高③具有很高的区分度和很好的选拔功能。它不仅考查考生对元素及其化合物主干知识掌握的情况 ,更能考查考生思维的敏捷性、发散性、严密性和分析推理综合应用元素化合物知识的能力。
二、解题“五步曲”:
1.审: 审清题意,从题干→问题→框图迅速浏览一遍,尽量在框图中把相关信息表示出来,明确求解要求 。
2.找: 找“题眼” 即找到解题的突破口,此步非常关键。
3.析: 从题眼出发,联系新信息及所学的旧知识,大胆猜测,顺藤摸瓜,应用正逆向思维、发散收敛思维、横向纵向思维等多种思维方式、进行综合分析、推理,初步得出结论。
4.验: 验证确认将结果放入原题检验,完全符合才算正确。
5.答: 按题目的要求写出答案。
三、破题最关键:找“题眼”
 |
|
四.常见“题眼”归类解析
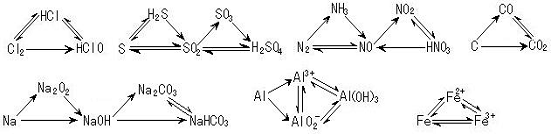
方法一:根据物质的特殊颜色推断
知识准备:物质颜色
1. 有色固体:红色:Cu、Cu2O、Fe2O3; 褐色:Fe(OH)3; 黄色:AgI、Ag3PO4;
浅黄色:S或Na2O2或AgBr; 蓝色:Cu(OH)2; 紫黑色:KMnO4 I2
黑色:炭粉、CuO、FeO、FeS、CuS、Ag2S、PbS;
白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3;
2. 有色溶液:Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)、MnO4-(紫红色)、
![]() (x=1~6)(红色)
(x=1~6)(红色)
| 水(溶剂) | 苯(溶剂) | CCl4(溶剂) | |
| Br2 | 黄→橙 | 黄→橙红 | |
| I2 | 深黄→褐 | 淡紫→紫红 | 紫→深紫 |
3.有色气体:Cl2(黄绿色)、Br2(g)(红棕色)、NO2、(红棕色)、I2(紫色)O3(淡蓝色)
例1、 (12分)下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。请按要求填空:
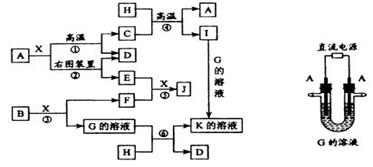
(1)写出B的电子式:____________________________________。
(2)写出生成E的电极反应式:_____________________________________,
反应⑤的现象是___________________________________________。
(3)反应①的化学方程式是_________________________________________,
在实验室中引发反应④的操作是______________________________________。
![]() (4)反应⑥的离子方程式是________________________________________。
(4)反应⑥的离子方程式是________________________________________。
答案(12分) (1)
|
(3)3Fe+4H2O Fe3O4+4H2 加少量KClO3,插上镁条并将其点燃
(4)2Al+2OH-+2 H2O =2AlO2-+3H2↑
方法二、根据特征反应现象推断
知识准备:特征反应现象:
1..焰色反应:Na+(黄色)、K+(紫色)
2.使品红溶液褪色的气体:SO2(加热后又恢复红色)、Cl2(加热后不恢复红色)
3.![]() (由白色→灰绿→红褐色)
(由白色→灰绿→红褐色)
4.在空气中变为红棕色:NO
5.气体燃烧呈苍白色:H2在Cl2中燃烧;在空气中点燃呈蓝色:CO、H2、CH4
6.使湿润的红色石蕊试纸变蓝:NH3
7.使湿润的淀粉碘化钾试纸变蓝:Cl2、Br2、FeCl3、碘水等。
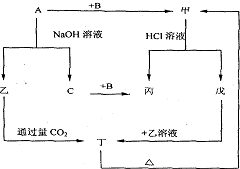
例2、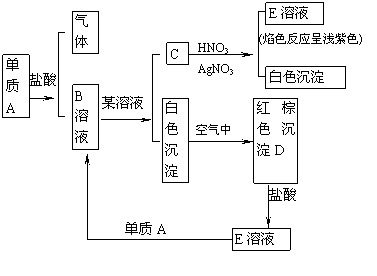 根据左图,指出A、B、C、D、E各是什么物质?
根据左图,指出A、B、C、D、E各是什么物质?
A.
B.
C.
D.
E.
答案: A、Fe B、FeCl2 C、KCl D、Fe(OH)3, E、FeCl3
方法三、根据特殊反应条件推断
知识准备:熟悉具有特殊反应条件的反应,多数是重要工业生产反应
![]()
![]() 1温高压催化剂
1温高压催化剂
2.催化剂、加热
![]()
![]()
![]() 3.电解 2H2O电解H2 +O2
3.电解 2H2O电解H2 +O2
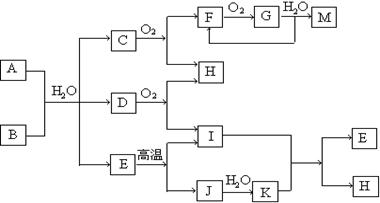
例3、(10分)下列是中学化学中常见物质间的反应转化关系图,其中部分产物已略去。常温下,G为固体单质,B、I为液体,其余都为气体。A为化合物,I的浓溶液与G在加热条件下生成F、B和C。H可用作工业上冶炼金属的还原剂。
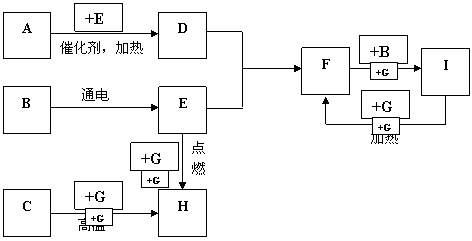
请按要求填空:
(1)写出下列物质的化学式:A: ; B: ; C: 。
(2)写出A→D的化学方程式 。
(3)写出G和I的浓溶液反应的化学方程式 。
答案(10分)(1)NH3
H2O CO2 (2)4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
(3)C +4 HNO3(浓)![]() CO2↑+ 4NO2↑+ 2H2O
CO2↑+ 4NO2↑+ 2H2O
方法四、根据特征转化关系推断
知识准备:
1、掌握一些特别的连续变化关系
(1)![]()
①![]()
②![]()
③![]()
④![]()
(2)A— 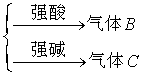
A为弱酸的铵盐:(NH4)2CO3或NH4HCO3 ;(NH4)2S或NH4HS;(NH4)2SO3、NH4HSO3
2、注意几个典型转化关系
三角转化:
3与碱反应产生气体
⑴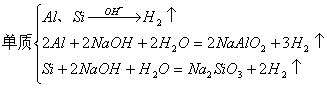
⑵铵盐:![]()
例4、(12分)已知A为酸式盐,B为某二价主族金属元素的化合物,常温常压下C、D、F、G、I均呈气态。等物质的量A、B与少量的水充分混合能恰好完全反应。图中反应条件(除高温外)均已略去。
(1)写出B的电子式 ,D的结构简式 。
(2)写出A与B反应的化学方程式 。
(3)如对气体G进行加压操作,产生的现象是 。
(4)写出下列反应的离子方程式:
①在A溶液中加入M 。
②向A溶液中加入过量NaOH溶液,并加热 。
答案:(1)
;CH![]() CH (2)CaC2 + NH4HCO3 = NH3↑+C2H2↑+CaCO3↓
CH (2)CaC2 + NH4HCO3 = NH3↑+C2H2↑+CaCO3↓
(3)气体的红棕色先变深后变浅
(4)①HCO3- +H+ = H2O +CO2↑
②NH4+ +HCO3- +2OH- = NH3↑+2H2O+CO32-
方法五、根据特殊工业生产推断
知识准备:重要工业生产反应
1、煅烧石灰石 2、煅烧黄铁矿 3、二氧化硫的催化氧化 4、氨的催化氧化5、合成氨 6、电解饱和食盐水 7、工业制盐酸 8、高炉炼铁 9、工业制取漂粉精10、工业制水煤气 11、硅酸盐工业
 例5、5. 10分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图的转换关系,甲是工业上制取A的主要原料。请回答:
例5、5. 10分)由短周期元素组成的单质A、B、C和甲、乙、丙、丁、戊五种化合物有下图的转换关系,甲是工业上制取A的主要原料。请回答:
(1)写出下列物质的化学式:
A____________乙_______。
(2)写出甲物质在工业上的任两种主要用途
_______________________________________。
(3)写出下列变化的化学方程式:
①A与NaOH溶液反应的化学方程式 ______________________________。
②乙与过量CO2反应的离子方程式 _________________________。
③戊溶液与乙溶液混合的离子方程式 _______________________________。
(1) A—Al 乙—NaAlO2 (2) 耐高温材料、轴承 制取铝单质
(3)①2Al+2NaOH+2H2O=2NaAlO2+3H2↑ ②AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
③Al3++3AlO2-+6H2O=4Al(OH)3↓
六、根据特征数据推断
知识准备:近两年计算型推断题成为高考热点之一,解这类题时要善于抓住物质转化时相对分子质量的变化(例CO→CO2,NO → NO2,SO2→SO3转化时分子中都增加1个氧原子,相对分子质量变化均为16 );放出气体的体积或生成沉淀的量;化合物中各元素的含量;气体的相对密度;相对分子质量;离子化合物中离子个数比;反应物之间的物质的量比;电子总数;质子总数等重要数据。
例6、已知甲、乙、丙为常见单质,A、B、C、D、E、F、G、X均为常见的化合物;B和X的摩尔质量相同,E的相对分子质量比D的相对分子质量大16,在一定条件下,各物质相互转化关系如下图所示:
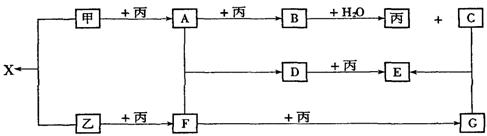
(1)写出X的电子式和G的化学式:X__________,G__________;
(2)写出有关变化的化学方程式:
B+H2O:______________________________;
D+丙:______________________________。
[小结]:
无机框图题推断题加强了学生知觉思维(顿悟)能力的培养和考查,纵查各学科,唯化学在这方面做的较为成功,此类题在在理综试卷中重现率几乎为100℅,应引起考生足够的重视。特别是要不断总结破题的方法—题眼的总结与归纳,从而掌握打开此类题的“金钥匙”。
[教学反思]